1、选择题 关于浓度均为0.1?mol/L的三种溶液:①氨水、②盐酸、③氯化铵溶液,下列说法不正确的是?
[? ]
?A.c(NH4+):③>①?
?B.水电离出的c(H+):②>①?
?C.①和②等体积混合后的溶液:c(H+)=c(OH-)+c(NH3·H2O)?
?D.①和③等体积混合后的溶液:c(NH4+)>c(Cl-)>c(OH-)>c(H+)
参考答案:B
本题解析:
本题难度:一般
2、填空题 有以下物质?①Fe、②AgCl固体、③熔融Ba?(OH)2、④Al2(SO4)3溶液、⑤SO2、⑥蔗糖溶液、⑦食盐水、⑧H2CO3、⑨无水乙醇(C2H5OH).其中能导电的物质有(填数字序号,下同):______;属于非电解质的有______;属于电解质的有______,请写出其中一种电解质在水溶液中的电离方程式______.
参考答案:①Fe能导电;
②AgCl固体是电解质,电离方程式为AgCl=Ag++Cl-;
③熔融Ba?(OH)2是电解质且能导电,电离方程式为Ba(OH)2=Ba2++2OH;
④Al2(SO4)3溶液能导电;
⑤SO2是非电解质;
⑥蔗糖溶液是混合物,不能导电⑦
食盐水能导电;
⑧H2CO3是电解质,其电离方程式为H2CO3电离
本题解析:
本题难度:简单
3、选择题 常温下,有c(CH3COOH)+c(CH3COO-)=0.1mol?L-1的一组醋酸和醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH值的关系如图所示.下列有关离子浓度关系叙述正确的是?( )

A.pH=5.5溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)
B.W点表示溶液中:c(Na+)+c(H+)=c(CH3COO-)+c(OH-)+c(CH3COOH)
C.pH=3.5溶液中:c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.1?mol?L-1
D.向W点所表示溶液中通入0.05molHCl气体(溶液体积变化可忽略):c(H+)=c(CH3COOH)+c(OH-)
参考答案:A.pH=5.5比4.75大,W点时c(CH3COOH)=c(CH3COO-),从曲线来看当pH=5.5时,c(CH3COOH)<c(CH3COO-),故A错误;
B.溶液存在电荷守恒,应为c(Na+)+c(H+)=c(CH3COO-)+c(OH-),故B错误;
C.pH=3.5溶液中c(Na+)+c(H+)=c(CH3COO-)+c(OH-),再把题干中的c(CH3COOH)+c(CH3COO-)=0.1mol?L-1代入即可得c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.1?mol?L-1,故C正确;
D.向W点所表示溶液中通入0.05molHCl气体,原有平衡被打破,建立起了新的平衡,溶液中电荷守恒关系为:c(Na+)+c(H+)=c(CH3COO-)+c(OH-)+c(Cl-);物料守恒关系为:2c(Na+)=c(CH3COO-)+c(CH3COOH)=0.1mol?L-1,不可能得出上述结论,故D错误.
故选C.
本题解析:
本题难度:一般
4、选择题 25℃时,在20 mL 0.1 mol/L NaOH溶液中逐滴加入0.2 mol/L醋酸溶液,pH的变化曲线如图所示,有关粒子浓度关系的比较中,不正确的是
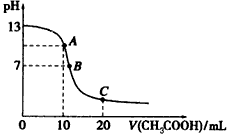
[? ]
A.在A点:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
B.在B点:c(Na+)=c(CH3COO-)>c(OH-)=c(H+)
C.在C点:c(CH3COO-)+c(CH3COOH)=2c(Na+)
D.在C点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
参考答案:A
本题解析:
本题难度:一般
5、选择题 下列叙述中,能说明某化合物一定是弱电解质的是
A.该化合物水溶液和熔融状态下均不导电
B.该化合物饱和溶液导电能力较弱
C.该化合物在熔融时不导电
D.该化合物溶于水发生电离,平衡时,溶质离子浓度小于溶质分子浓度
参考答案:D
本题解析:化合物在水溶液中和熔融状态下均不导电,说明该化合物是非电解质,A选项不合题意;难溶于水的强电解质的饱和溶液中离子浓度较小,导电能力较弱,所以B选项不符合题意;化合物熔融时不导电,但溶于水能导电,如硫酸、氯化氢等都是强电解质;D选项中,化合物溶于水后发生电离,说明是电解质,而溶液中既有溶质离子又有溶质分子,说明电解质没有完全电离,一定是弱电解质.
本题难度:简单