| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点讲解《能量的相互转化》高频考点强化练习(2019年最新版)(四)
 且a、b、c均大于零,则断开1 mol H-Cl键所需的能量为- a-b-c kJ 参考答案:A 本题解析:A、水分解过程是吸热反应,使用催化剂会降低活化能,正确;B、燃烧热是生成稳定的产物(如CO2)放出的热量,错误;C、加热与吸热、放热反应无关,如金属的燃烧多数需要加热,错误正确;D、1mol H-Cl键所需的能量为(- a-b-c)/2kJ。 本题难度:一般 3、填空题 硫酸氢钠(NaHSO4)在水溶液中可以完全电离为Na+和HSO |
参考答案:(1)B?(2)<
(3)2NaHSO4+Na2CO3 2Na2SO4+H2O+CO2↑
2Na2SO4+H2O+CO2↑
2H++CO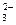
 H2O+CO2↑
H2O+CO2↑
本题解析:HSO 可以看成H2SO4电离产生的一种酸根离子,这样硫酸氢钠可看成是由金属阳离子Na+与酸根阴离子HSO
可以看成H2SO4电离产生的一种酸根离子,这样硫酸氢钠可看成是由金属阳离子Na+与酸根阴离子HSO 组成的,因而它是一种盐。由于硫酸氢钠电离出的阳离子并不都是H+,因此它既不属于酸也不属于一般的盐,而是一种酸式盐。
组成的,因而它是一种盐。由于硫酸氢钠电离出的阳离子并不都是H+,因此它既不属于酸也不属于一般的盐,而是一种酸式盐。
由于HSO 电离可以产生H+,故其水溶液应该显酸性,其pH<7。
电离可以产生H+,故其水溶液应该显酸性,其pH<7。
稀NaHSO4溶液与Na2CO3溶液反应得到的无色、无味、可使澄清石灰水变浑浊的气体应该是二氧化碳。HSO 在稀溶液里完全电离为H+和SO
在稀溶液里完全电离为H+和SO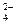 ,则NaHSO4溶液与Na2CO3溶液的反应实质上就是H+与CO
,则NaHSO4溶液与Na2CO3溶液的反应实质上就是H+与CO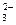 的反应。
的反应。
本题难度:一般
4、填空题 已知拆开1 mol H—H键、1 mol I—I、1 mol H—I键分别需要吸收的能量为436kJ、151k J、299k J。则由氢气和单质碘反应生成1 mol HI需要?(填“放出”或“吸收”)??k J的热量。
参考答案:放出?;? 5.5
本题解析:氢气和单质碘反应的方程式:H2+I2="2HI," 拆开1 mol H—H键、1 mol I—I、1 mol H—I键分别需要吸收的能量为436kJ、151k J、299k J,可知由氢气和单质碘反应生成2mol HI需要放出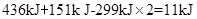 ,而生成1mol HI需要放出
,而生成1mol HI需要放出
点评:化学反应与能量的变化是高考的一个高考,难度不大,计算量也不大,考生要抓住放热反应反应物总能量大于生成物总能量的特征,即可解答。
本题难度:一般
5、填空题 ______既是化学反应过程的本质,又是化学反应中能量变化的主要原因.?从能量的角度看,断开化学键要______,形成化学键要______.一个化学反应是吸收能量(热量)还是放出能量(热量),取决于______.
参考答案:化学反应的本质是化学键的断裂与形成,化学反应中能量变化的微观表现是断开化学键吸收的能量与形成化学键放出的能量不相等,若为若为放热反应,断开化学键吸收的能量小于形成化学键放出的能量,若为吸热反应,断开化学键吸收的能量大于形成化学键放出的能量.
故答案为:化学键的断裂与形成;吸收能量;放出能量;断开化学键吸收的能量多,还是形成化学键释放的能量多.
本题解析:
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点讲解《烃》高频考.. | |