1、选择题 下列图示与对应的叙述相符的是?
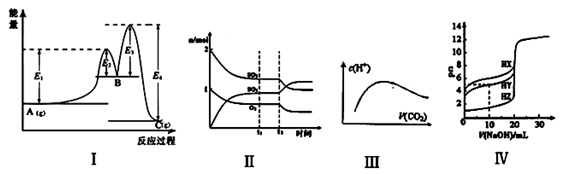
A.图Ⅰ中 可以看出反应A(g)=C(g)的△H=(E1-E4)kJ·mol-1
B.图Ⅱ表示一定条件下进行的反应2SO2+O2 2SO3 各成分的物质的量变化,t2时刻改变的条件可能是扩大了容器的体积
2SO3 各成分的物质的量变化,t2时刻改变的条件可能是扩大了容器的体积
C.图Ⅲ表示将CO2通入NaOH的稀溶液中,随着CO2的通入,溶液中水电离出的c(H+)变化关系
D.图Ⅳ曲线表示用0.1000mol/LNaOH溶液分别滴定浓度相同的三种一元酸,由此可判断HX的酸性最强
参考答案:C
本题解析:A、根据图Ⅰ可以看出反应A(g)=C(g)的△H=[E1-(E4—E3+E2)]kJ·mol-1,错误;B、反应2SO2+O2 2SO3 正向为气体体积减小的反应,扩大容器的体积,平衡逆向移动,二氧化硫和氧气的物质的量增大,三氧化硫的物质的量减小,与图像不符,错误;C、将CO2通入NaOH的稀溶液中,发生的反应依次为CO2+2NaOH====Na2CO3+H2O,Na2CO3 + CO2+ H2O====2NaHCO3,氢氧化钠抑制水的电离,而碳酸钠水解,促进水的电离,水的电离程度逐渐增大,碳酸氢钠的水解程度小于碳酸钠,碳酸抑制水的电离,水的电离程度又逐渐减小,与图像相符,正确;D、由图Ⅳ曲线可知,浓度相同的三种一元酸,HX的pH最大,电离程度最小,HX的酸性最弱,错误。
2SO3 正向为气体体积减小的反应,扩大容器的体积,平衡逆向移动,二氧化硫和氧气的物质的量增大,三氧化硫的物质的量减小,与图像不符,错误;C、将CO2通入NaOH的稀溶液中,发生的反应依次为CO2+2NaOH====Na2CO3+H2O,Na2CO3 + CO2+ H2O====2NaHCO3,氢氧化钠抑制水的电离,而碳酸钠水解,促进水的电离,水的电离程度逐渐增大,碳酸氢钠的水解程度小于碳酸钠,碳酸抑制水的电离,水的电离程度又逐渐减小,与图像相符,正确;D、由图Ⅳ曲线可知,浓度相同的三种一元酸,HX的pH最大,电离程度最小,HX的酸性最弱,错误。
本题难度:一般
2、填空题 请参考题中图表,已知E1=134 kJ·mol-1、E2=368 kJ·mol-1,根据要求回答问题:
 ?
?
(1)图Ⅰ是1 mol NO2(g)和1 mol CO(g)反应生成CO2和NO过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是?(填“增大”、“减小”或“不变”,下同),ΔH的变化是?。请写出NO2和CO反应的热化学方程式:?。
(2)甲醇质子交换膜燃料电池中将甲醇蒸汽转化为氢气的两种反应的热化学方程式如下:
①CH3OH(g)+H2O(g)===CO2(g)+3H2(g)? ΔH=+49.0 kJ·mol-1
②CH3OH(g)+O2(g)===CO2(g)+2H2(g)? ΔH=-192.9 kJ·mol-1
又知③H2O(g)===H2O(l) ΔH=-44 kJ·mol-1,则甲醇蒸汽燃烧为液态水的热化学方程式为?。
(3)如表所示是部分化学键的键能参数:
化学键
| P—P
| P—O
| O===O
| P===O
|
键能/kJ·mol-1
| a
| b
| c
| x
|
?
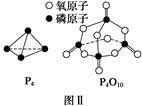
已知白磷的燃烧热为d kJ·mol-1,白磷及其完全燃烧的产物的结构如图Ⅱ所示,则表中x=??kJ·mol-1(用含a、b、c、d的代表数式表示)。
参考答案:(1)减小 不变 NO2(g)+CO(g)===CO2(g)+NO(g) ΔH=-234 kJ·mol-1
(2)CH3OH(g)+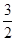 O2(g)===CO2(g)+2H2O(l) ΔH=-764.7 kJ·mol-1
O2(g)===CO2(g)+2H2O(l) ΔH=-764.7 kJ·mol-1
(3)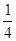 (d+6a+5c-12b)
(d+6a+5c-12b)
本题解析:(1)观察图像,E1应为反应的活化能,加入催化剂反应的活化能降低,但是ΔH不变;1 mol NO2(g)和1 mol CO(g)反应生成CO2和NO的反应热数值即反应物和生成物的能量差,因此该反应的热化学方程式为NO2(g)+CO(g)===CO2(g)+NO(g) ΔH=-234 kJ·mol-1。
(2)观察方程式,利用盖斯定律,将所给热化学方程式作如下运算:②×3-①×2+③×2,即可求出甲醇蒸汽燃烧的热化学方程式。
(3)白磷燃烧的化学方程式为P4+5O2 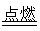 P4O10,结合图Ⅱ中白磷及其完全燃烧产物的结构,根据“反应热=反应物键能总和-生成物键能总和”与燃烧热概念可得等式:6a+5c-(4x+12b)=-d,据此可得 x=
P4O10,结合图Ⅱ中白磷及其完全燃烧产物的结构,根据“反应热=反应物键能总和-生成物键能总和”与燃烧热概念可得等式:6a+5c-(4x+12b)=-d,据此可得 x=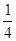 (d+6a+5c-12b)。
(d+6a+5c-12b)。
本题难度:一般
3、选择题 下列关于热化学反应的描述中正确的是? ( )
A.已知H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,则H2SO4和Ba(OH)2反应的反应热ΔH=2×(-57.3) kJ·mol-1
B.燃料电池中将甲醇蒸气转化为氢气的热化学方程式是CH3OH(g)+ O2(g)===CO2(g)+2H2(g)ΔH=-192.9 kJ·mol-1,则CH3OH(g)的燃烧热为192.9 kJ·mol-1
O2(g)===CO2(g)+2H2(g)ΔH=-192.9 kJ·mol-1,则CH3OH(g)的燃烧热为192.9 kJ·mol-1
C.H2(g)的燃烧热是285.8 kJ·mol-1,则2H2O(g)===2H2(g)+O2(g) ΔH=571.6 kJ·mol-1
D.葡萄糖的燃烧热是2 800 kJ·mol-1,则 C6H12O6(s)+3O2(g)===3CO2(g)+3H2O(l) ΔH=-1 400 kJ·mol-1
C6H12O6(s)+3O2(g)===3CO2(g)+3H2O(l) ΔH=-1 400 kJ·mol-1
参考答案:D
本题解析:A、中和热是指稀溶液中,强酸和强碱发生中和反应生成1molH2O所放出的热量,生成2molH2O所放出的热量为2×57.3kJ,但生成硫酸钡沉淀的反应还要吸收热量,则H2SO4和Ba(OH)2反应的反应热小于2×(-57.3)kJ?mol-1,故A错误;B、由燃烧热的概念可知,甲醇燃烧应生成液态水,则CH3OH的燃烧热一定不为192.9kJ?mol-1,故B错误;C、H2(g)的燃烧热是285.8kJ?mol-1,生成液态水,则2H2O(l)=2H2(g)+O2(g) △H=+571.6kJ?mol-1,故C错误;D、燃烧热是指1mol可燃物完全燃烧生成稳定的氧化物所放出的热量,葡萄糖的燃烧热是2800kJ?mol-1,则 C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l)△H=-1400kJ?mol-1,故D正确;故选D。
C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l)△H=-1400kJ?mol-1,故D正确;故选D。
本题难度:一般
4、选择题 已知3克乙烷在常温下完全燃烧放出的热量是155.98kJ,则下列乙烷燃烧热的热化学方程式书写正确的是(?)
A.2C2H6(g)+7O2(g)=4CO2(g)+6H2O(g)△H ="-2119.6" kJ/mol
B.C2H6(g)+5/2O2(g)=2CO2(g)+3H2O(g)△H ="-1559.8kJ/mol"
C.C2H6(g)+7/2O2(g)=2CO2(g)+3H2O(g)△H ="-1559.8" kJ/mol
D.C2H6(g)+7/2O2(g)=2CO2(g)+3H2O(l)△H ="-1559.8" kJ/mol
参考答案:D
本题解析:由题目所给信息可折算出1mol乙烷完全燃烧时所放出的热量为1559.8 kJ,再结合燃烧热的概念(1mol可燃物完全燃烧生成稳定的氧化物所放出的热量),则答案为D
本题难度:一般
5、选择题 下列反应中,反应物总能量低于生成物总能量的是(?)
A.C + CO2=2CO
B.C + O2=CO2
C.2C + O2= 2CO
D.C + CuO=CO2 + Cu
参考答案:A
本题解析:反应物总能量低于生成物总能量,反应吸热。选项B、C是燃烧反应,放热;选项D,碳粉与氧化铜的反应虽然需要高温的条件,但是该反应有气体放出,所以该反应还是可以进行的。故答案为A。
点评:考查化学反应与能量,熟记常见反应的吸热与放热即可。
本题难度:简单