1、填空题 (12分)将化学知识系统化,有助于对化学问题的进一步认识和理解。
资料1:化学反应的碰撞理论:反应物分子间的相互碰撞是反应进行的必要条件,但并不是每次碰撞都能引起反应,只有少数碰撞才能发生化学反应。能引发化学反应的碰撞称之为有效碰撞。
资料2:化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态。
资料3:化学反应的能量变化(ΔH)与反应物和生成物的键能有关。在热力学标准态(298K、1.01×105Pa)下,由稳定的单质发生反应生成1mol化合物的反应热叫该化合物的生成热(ΔH)。
根据以上资料回答下列问题:
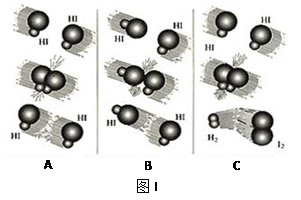
(1)图I是HI分解反应中HI分子之间的几种碰撞示意图,其中属于有效碰撞的是
__________________(选填“A”、“B”或“C”);
(2)图Ⅱ是1molNO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO
反应的热化学方程式:
___________________________________________;

(3)?下表是部分化学键的键能数据:
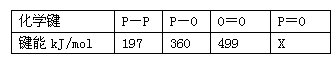
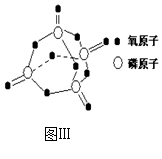
已知白磷的燃烧热为2378.0? kJ/mol,白磷完全燃烧的产物结构(P4O10)如图Ⅲ所示,则上表中
X=_______________________________。
(4)图Ⅳ为氧族元素的氢化物a、b、c、d的生成热数据示意图。

请你归纳:非金属元素的氢化物的稳定性与氢化物的生成热(ΔH)
之间的关系:_____________________________________。
参考答案:(1)?C
(2)NO2(g)+CO(g) =CO2(g)+NO(g);△H=-234?kJ/mol
(3)434(433.75)
(4)非金属元素的氢化物越稳定,△H越小,反之亦然
本题解析:(1)其中属于有效碰撞的是C
(2)请写出NO2和CO反应的热化学方程式:NO2(g)+CO(g) =CO2(g)+NO(g) △H=-234?kJ/mol
(3)上表中X=434(433.75)根据生成1mol五氧化二磷生成新键放出的热量减去反应物断开旧键吸收的热量等于白磷的燃烧热
(4)非金属元素的氢化物越稳定,△H越小,反之亦然
本题难度:简单
2、选择题 下列对化学反应的认识,不正确的是
A.化学反应必然引起物质状态的变化
B.化学反应会引起化学键的变化
C.化学反应必然伴随着能量的变化
D.化学反应会产生新的物质
参考答案:A
本题解析:化学反应不一定会伴随状态的变化,例如合成氨,A是不正确,其余都是最强的,答案选A。
本题难度:简单
3、选择题 下列过程中,需要吸收能量的是
A.H+H=H2
B.H+Cl=HCl
C.I2→I+I
D.S+O2=SO2
参考答案:C
本题解析:断键需要吸热,即分子变成原子是吸热过程,而原子形成分子的过程则是放热的,C正确。其余都是放热过程,答案选C。
本题难度:简单
4、选择题 下列反应属于放热反应的是(?)
A.Ba(OH)2·8H2O与NH4Cl反应
B.碳酸钙受热分解
C.C与CO2在高温下反应
D.H2与Cl2燃烧反应
参考答案:D
本题解析:考查常见的放热反应。一般化合反应是放热反应,金属和水或酸的反应是化合反应,中和反应是放热反应,物质的燃烧是放热反应。所以正确的答案是D。
本题难度:简单
5、选择题 化学反应一般均会伴随着能量变化,对CH4在O2中燃烧的反应,正确的是
A.该反应为吸热反应
B.该反应为放热反应
C.断裂C-H键吸收能量
D.生成H-O键吸收能量
参考答案:BC
本题解析:甲烷燃烧是放热反应,A不正确,B正确。断键是吸热的,形成化学键是放热的,C正确,D不正确,答案选BC。
点评:该题是中等难度的试题,试题基础性强,侧重对学生基础知识的巩固与训练。有利于培养学生灵活运用基础知识解决实际问题的能力,提高学生的应试能力。该题的关键是明确反应热的含义和计算依据,并能结合题意灵活运用即可。
本题难度:简单