1、选择题 “中和热”是一个热化学中的重要概念,“中和热”的定义为:在稀溶液中,酸跟碱发生中和反应生成1mol H2O时的反应热叫做中和热。以下关于中和热的叙述正确的是
A.在稀溶液中所有酸和碱反应的中和热数值都相等
B.在稀溶液中1mol酸和1mol碱反应放出的热量都相等
C.在稀溶液中HCl和NaOH反应的中和热与HNO3和KOH反应的中和热数值相等
D.将浓硫酸滴入氢氧化钠溶液中刚好生成1mol水时,产生的热量即为中和热
参考答案:C
本题解析:考查中和热的概念
酸、碱的元数、强弱、溶液的浓度等均可影响中和反应所放出的热量,故排除AB,C符合题意;
D项中浓硫酸在与其它水溶液混合的过量中会放出大量的热,但并非中和热,排除
本题难度:简单
2、选择题 化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如下图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化:
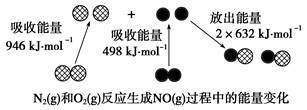
下列说法正确的是(?)
A.1 mol N2(g)和1 mol O2(g)反应放出的能量为180 kJ
B.1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量
C.通常情况下,N2(g)和O2(g)混合能直接生成NO
D.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水
参考答案:B
本题解析:A、根据题给数据可知,反应物中化学键断裂吸收能量:(946+498)=1444kJ/mol,生成物中化学键的形成放出能量2×632=1264?kJ/mol,故1 mol N2(g)和1 mol O2(g)反应吸收的能量为180 kJ,错误;B、根据题给数据知,N2(g)和O2(g)的反应是吸热反应, 1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量,正确;C、N2(g)和O2(g)的反应需要在放电条件下进行,通常情况下,N2(g)和O2(g)混合不能直接生成NO,错误;D、一氧化氮不能和氢氧化钠反应,属于不成盐氧化物,错误。
本题难度:一般
3、选择题 下列陈述Ⅰ、Ⅱ正确并且因果关系合理的是
A.A
B.B
C.C
D.D
参考答案:D
本题解析:分析:A、二氧化硫具有漂白性,还原性;浓硫酸不能干燥氨气、硫化氢、溴化氢和碘化氢;
B、NH4Cl溶液和氨水中含有自由移动的离子而导电;强电解质在水溶液中能完全电离的化合物;
C、84”消毒液呈碱性,二氧化硅能和碱反应生成具有粘合性的硅酸钠;
D、氧化铝的熔点很高,可作耐火材料.
解答:A、二氧化硫具有漂白性,还原性,SO2能用浓硫酸干燥;陈述Ⅰ正确、Ⅱ不正确,无因果关系,故A错误;
B、NH4Cl溶液和氨水中含有自由移动的离子而导电;NH4Cl溶液和氨水都是混合物,不是强电解质,陈述Ⅰ正确、Ⅱ错误,无因果关系,故B错误;
C、84”消毒液呈碱性,二氧化硅能和碱反应生成具有粘合性的硅酸钠,从而将瓶塞和瓶口粘结在一起,陈述Ⅰ不正确、Ⅱ正确,有因果关系,故C错误;
D、氧化铝的熔点很高,所以氧化铝用来制造耐火坩埚和耐高温的实验仪器,陈述Ⅰ正确、Ⅱ正确,且有因果关系,故D正确;
故选D.
点评:本题考查了物质性质的分析应用,主要是浓硫酸、盐类水解、氧化铝等物质性质的应用,题目难度中等.
本题难度:困难
4、选择题 已知热化学方程式:SO2(g)+ 1/2O2(g)  ?SO3(g) △H= ―98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为?(?)
?SO3(g) △H= ―98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为?(?)
A.196.64kJ
B.196.64kJ/mol
C.<196.64kJ
D.>196.64kJ
参考答案:C
本题解析:略
本题难度:简单
5、填空题 (6分)如图所示,在一个小烧杯里加入研细的20g Ba(OH)2·8H2O晶体。将此小烧杯放在事先滴有3~4滴水的玻璃片上,然后向小烧杯中加入10g NH4Cl晶体,并用玻璃棒快速搅拌。
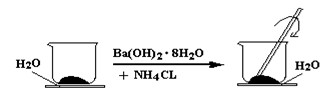
 (1)实验中要用玻璃棒搅拌的原因是?
(1)实验中要用玻璃棒搅拌的原因是?
 ?(2)写出有关反应的化学方程式:?,
?(2)写出有关反应的化学方程式:?,
该反应?(填“是”或“不是”)氧化还原反应。&s.5*u.c.#om
(3)该实验中观察到的现象除产生刺激性气味的气体及反应混合物呈糊状以外,还有
 ?。
?。
(4)通过最后一个现象可以说明该反应为_________(填“吸”或“放”)热反应,这是由于反应物的总能量_________(填“大于”或“小于”)生成物的总能量。
参考答案:
(1)该反应是固体之间的反应,搅拌可使混合物充分接触并发生反应
(2) Ba(OH)2·8H2O +2NH4Cl = BaCl2 +2NH3↑ +10 H2O?不是
(3) 玻璃片上因结冰而与小烧杯粘在一起
(4) 吸,小于
本题解析:略
本题难度:简单