1、简答题 A、B、C、D均为中学化学中常见的单质或化合物,它们之间的关系如图所示(部分产物已略去)。
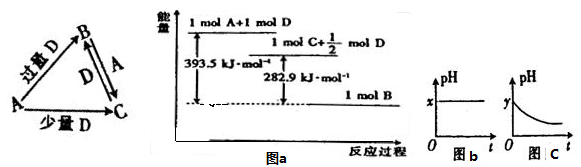 ?
?
(1)若A为金属单质,D是某强酸的稀溶液,则反应C+D→B的离子方程式为?;
(2)若A、B为盐,D为强碱,A的水溶液显酸性,则
①C的化学式为?;
②反应B+A→C的离子方程式为?;
(3)若A为强碱,D为气态氧化物。常温时,将B的水溶液露置于空气中,其pH随时间t变化可能如上图的图b或图c所示(不考虑D的溶解和水的挥发)。
①若图b符合事实,则D的化学式为?;
②若图c符合事实,则其pH变化的原因是?(用离子方程式表示);
(4)若A为非金属单质,D是空气的主要成分之一。它们之间转化时能量变化如上图a,请写出A+D→C的热化学方程式?;
参考答案:(1)3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O
(2)①Al(OH)3
②Al3++3AlO2-+6H2O=4Al(OH)3↓
(3)①CO2 ②2HSO3-+O2=2H++2SO42-
(4)C(s)+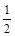 O2(g)="CO(g)" ⊿H=-110.6kJ/mol
O2(g)="CO(g)" ⊿H=-110.6kJ/mol
本题解析:(1)A为金属单质,随D酸的稀溶液的量的不同而产物不同,故A是变价金属,故是Fe,D酸具有氧化性,稀溶液具有氧化性的酸是HNO3,故C+D→B反应为3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O;
(2)A、B为盐,A随强碱D溶液的量的不同而产物不同,A的水溶液显酸性,则是Al3+,C为Al(OH)3,B+A→C为Al3++3AlO2-+6H2O=4Al(OH)3↓;
(3)A为强碱,D为气态氧化物,D为二元酸酸酐,可以是CO2或SO2,b图是pH不变,为CO2;pH减小的是SO2,因为亚硫酸在空气中易氧化为硫酸使pH减小,即2HSO3-+O2=2H++2SO42-;
(4)A为非金属单质,空气主要成分D易反应是O2,能量关系看出反应计量:A+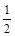 O2→C,C+
O2→C,C+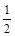 O2→B,A元素有+2、+4价,故A是碳,A+D→C的热化学方程式是C(s)+
O2→B,A元素有+2、+4价,故A是碳,A+D→C的热化学方程式是C(s)+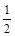 O2(g)="CO(g)" ⊿H=-110.6kJ/mol。
O2(g)="CO(g)" ⊿H=-110.6kJ/mol。
本题难度:一般
2、选择题 下列叙述正确的是
A.Fe在氯气中燃烧生成FeCl2
B.将AlCl3溶液逐滴滴入到NaOH溶液,先产生白色沉淀,最后沉淀消失
C.铁粉中混有铝粉既可用过量的NaOH溶液,也可以用过量FeCl3充分反应过滤除去
D.常温下,铝制品用浓硫酸或浓硝酸处理过,可耐腐蚀
参考答案:D
本题解析:A.? Fe在氯气中燃烧生成FeCl3;错误 B?将AlCl3溶液逐滴滴入到NaOH溶液,开始不会产生白色沉淀,错误;C.铁粉中混有铝粉既可用过量的NaOH溶液,但不能用过量FeCl3充分反应,因为Fe与FeCl3也反应;错误;D正确。
本题难度:一般
3、选择题 有100 mL 3 mol·L-1 NaOH溶液和100 mL 1 mol·L-1 AlCl3溶液。按如下两种方法进行实验:①将氢氧化钠溶液分多次加到AlCl3溶液中;②将AlCl3溶液分多次加到NaOH溶液中。比较两次实验的结果是
A.现象相同,沉淀量相等
B.现象不同,沉淀量不等
C.现象相同,沉淀量不等
D.现象不同,沉淀量相等
参考答案:D
本题解析:①现象为先沉淀后沉淀溶解;②现象为先无沉淀后有沉淀生成。因反应物给的量是相等了,故沉淀量是相等的。故选D。
点评:本题考查的是无机反应的知识和化学计算,AlCl3溶液分和NaOH溶反应,分析清楚滴加顺序不同反应就不同的原理是解题的关键,题目难度适中。
本题难度:一般
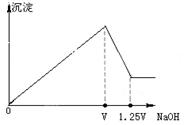
4、选择题 有 MgCl2、Al2(SO4)3的混合溶液,向其中不断加入NaOH溶液,得到的沉淀量与加入的NaOH溶液的关系如图所示,则原溶液中MgCl2、Al2(SO4)3的物质的量浓度之比为
A.1:1
B.2:1
C.3:2
D.2:3
参考答案:A
本题解析:向MgCl2、Al2(SO4)3的混合溶液逐滴加入NaOH溶液,发生反应Mg2++2OH-= Mg(OH)2↓, Al3++3OH-=Al(OH)3↓.所以沉淀逐渐增多。当NaOH过量时有发生反应:Al(OH)3+OH-=AlO2-+2 H2O.沉淀又逐渐减小,当氢氧化铝完全溶解后沉淀达到最小值。由于在沉淀溶解的反应中n(Al(OH)3):n(OH-) =1:1,n(OH-)=0.25V,所以n(Al3+)=n(Al(OH)3)= n(OH-)=0.25V,n(Al2(SO4)3)=1/2n(Al3+)=0.125V.使Al3+产生沉淀消耗的氢氧根离子的物质的量为3n(Al3+)=0.75V,则发生反应Mg2++2OH-= Mg(OH)2↓,消耗的氢氧根离子的物质的量为V-0.75V=0.25V,因此MgCl2的物质的量为1/2n(OH-)=0.125V.所以原溶液中MgCl2、Al2(SO4)3的物质的量之比为0.125V:0.125V=1:1.因此选项为A。2、Al2(SO4)3的混合溶液与NaOH溶液发生反应的情况的知识。
本题难度:一般
5、选择题 下列几种金属制品的镀层损坏后,金属腐蚀的速率最快的是( )
A.镀铝铁桶
B.食品铁罐头盒(镀锡)
C.白铁水桶(镀锌)
D.镀银铜质奖章
参考答案:B
本题解析:关键是看,镀层损坏后,暴露出的金属与镀层能否形成原电池,形成原电池金属是否是负极。镀铝铁桶镀层破损后,铝作负极被腐蚀;食品铁罐头盒(镀锡) 镀层破损后,铁做负极被腐蚀;白铁水桶(镀锌) 镀层破损后,锌作负极被腐蚀;镀银铜质奖章镀层破损后,铜做负极被腐蚀。但由于铁的活泼性强于铜的,所以选项B正确。
本题难度:简单