1、选择题 物质的量为0.20 mol的镁条在只含有CO2和O2混合气体的容器中燃烧(产物不含碳酸镁),反应后容器内固体物质的质量不可能为
A.6.4g
B.8.0g
C.8.4g
D.9.2g
2、填空题 锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱。但是氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成Zn(NH3)42+。回答下列问题:
(1)单质铝溶于氢氧化钠溶液后,溶液中铝元素的存在形式为_______________(用化学式表示)。
(2)写出锌和氢氧化钠溶液反应的化学方程式 ____________________。
(3)下列各组中的两种溶液,用相互滴加的实验方法即可鉴别的是____________________。(填序号)
① 硫酸铝和氢氧化钠 ② 硫酸铝和氨水③ 硫酸锌和氢氧化钠④ 硫酸锌和氨水
(4)写出可溶性铝盐与氨水反应的离子方程式 __________________________。试解释在实验室不适宜用可溶性锌盐与氨水反应制备氢氧化锌的原因_______________________
3、选择题 在实际生活中,下列说法正确的是( )
A.糖尿病是食用食糖过量造成的
B.日常生活中常用无水乙醇杀菌消毒
C.绿色食品是不含任何化学物质的食品
D.家庭中不宜长期食用铝质餐具盛放菜、汤等食物
4、填空题 Al及其化合物在工业上有极其广泛的用途,
(1)焊接钢轨时用Al冶炼Fe的反应方程式为?;铝的化合物明矾可用于净水,其原理用离子方程式解释为?。
(2)硅藻遗骸中主要成分是Al2O3、SiO2和Fe2O3。从中获取Al(OH)3的过程如下:
步骤I:取适量硅藻遗骸用70%H2SO4浸泡;
步骤II:向上述浸泡液中加入过量NaOH并过滤;
步骤III:向上述滤液中通入过量CO2过滤得到Al(OH)3。
①用70%H2SO4浸取硅藻遗骸的目的是?。
②步骤II中涉及铝元素的离子方程式为?;
③步骤III中能否用HCl代替CO2??(填“能”或“不能”);该步骤所得滤液中存在的电荷守恒式为?;向该滤液中滴加少量NaOH溶液,则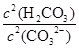 ?填(“变大”、“变小”或“不变”)
?填(“变大”、“变小”或“不变”)
(3)Al(OH)3可用作阻热材料,试从Al(OH)3的化学性质角度分析其原因?。
5、选择题 在1 L含0.1 mol NaAlO2和0.1 mol Ba(OH)2的混合溶液中,逐滴加入浓度为0.1 mol/L的H2SO4溶液,下列图象中能表示反应产生沉淀的物质的量与加入硫酸溶液体积之间关系的是(?)
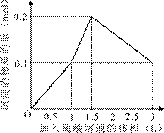 ?
?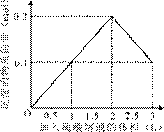 ?
?
A ?B
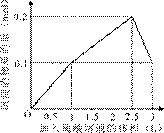 ?
?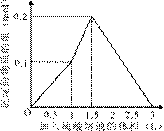
C? D