1、选择题 某烃有结构简式为CH3-CH2-CH=C-C≡CH,分子中含有四面体结构的碳原子(即
饱CH2CH3和碳原子)数为a,在同一直线上的碳原子数最多为b,在同一平面内的碳原子数
最少为c,则a、b、c分别为? (? )
A.4、3、5? B 4、3、6? C.2、5、4? D.4、6、4
参考答案:B
本题解析:因为CH≡CH结构为直线型? CH2=CH2中4个氢原子、2个碳原子在同一平面,由此判断即可
本题难度:简单
2、选择题 下列物质中含离子键的是( )
A.Cl2
B.CO2
C.NaCl
D.CH4
参考答案:C
本题解析:
本题难度:一般
3、选择题 下列用电子式表示的形成过程正确的是
[? ]
A.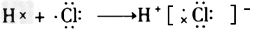 ?
?
B.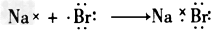
C.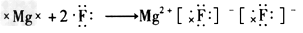 ?
?
D.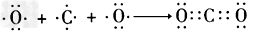
参考答案:D
本题解析:
本题难度:简单
4、选择题 已知A、B、C、D、E是核电荷数依次增大的五种短周期主族元素,原子半径按D、E、B、C、A的顺序依次减小,B和E同主族,下列推断不正确的是( )
A.D一定在第二周期
B.A、B、D不可能在同周期
C.A、D可能在同一主族
D.C和D的单质可能化合为离子化合物
参考答案:A
本题解析:
本题难度:一般
5、简答题 A、B、C、D四种短周期元素原子序数依次增大,A元素原子的价电子排列为ns2np2,B元素的最外层电子数是其电子层数的3倍,E元素原子的价电子排布为3d64s2.C、D的电离能数据如下(kJ?mol-1):
| I1 | I2 | I3 | I4
C
738
1451
7733
10540
D
577
1817
2745
11578
|
(1)化合价是元素的一种性质.由C、D的电离能数据判断,C通常显______价,D显______价;
(2)某单质甲分子与化合物AB分子中电子总数相等,则甲分子中包含______个σ键,______个π键;
(3)AB的总键能大于甲的总键能,但AB比甲容易参加化学反应.根据下表数据,说明AB比甲活泼的原因是______.
| 单键 | 双键 | 叁键
AB
键能(kJ?mol-1)
357.7
798.9
1071.9
甲
键能(kJ?mol-1)
154.8
418.4
941.7
|
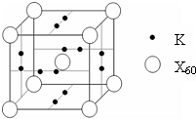 (4)E能与AB形成配合物,其中E提供______,AB提供______.
(4)E能与AB形成配合物,其中E提供______,AB提供______.
(5)如图所示晶胞中,阳离子与阴离子的个数为______.
参考答案:A、B、C、D四种短周期元素原子序数依次增大,B元素的最外层电子数是其电子层数的3倍,由于最外层电子数不超过8,1个电子层最多容纳2个电子,故B原子有2个电子层,最外层电子数为6,则B为氧元素;A元素原子的价电子排列为ns2np2,处于ⅣA族,原子序数小于氧元素,则A为碳元素;C元素的第三电离能剧增,表现+2价,处于ⅡA,原子序数大于氧元素,故C为Mg元素;D元素的第四电离能剧增,表现+3价,处于ⅢA族,则D为Al元素;E元素原子的价电子排布为3d64s2,核外电子数为26,为Fe元素,
(1)C元素的第三电离能剧增,表现+2价;D元素的第四电离能剧增,表现+3价,故答案为:+2;+3;
(2)某单质甲分子与化合物CO分子中电子总数相等,则甲分子为N2,分子中存在N≡N三键,包含1个σ键,2个π键,故答案为:1;2;
(3)据表中数据可知,断裂C≡O中的一个π键消耗的能量是1071.9kJ/mol-798.9kJ/mol=273kJ/mol,断裂N≡N中的一个π键消耗的能量是941.7kJ/mol-418.4kJ/mol=523.3kJ/mol,断裂一个π键CO比N2更容易,所以CO更活泼,
故答案为:断裂C≡O中的一个π键消耗的能量是273kJ/mol,断裂N≡N中的一个π键消耗的能量是523.3kJ/mol,断裂一个π键CO比N2更容易,所以CO更活泼;
(4)E为Fe,含有空轨道,CO含有孤对电子,二者形成配合物,故答案为:空轨道;孤对电子;
(5)由晶胞结构可知,晶胞中含有K+离子数目为2×6×12=6,阴离子数目为1+8×18=2,故阳离子与阴离子的个数为6:2=3:1,故答案为:3:1.
本题解析:
本题难度:简单