1、选择题 下列各组分子中,中心原子均采取sp3不等性杂化的是
A.PCl3、NH3
B.BF3、H2O
C.CCl4、H2S
D.BeCl2、BF3
参考答案:A
本题解析:如果形成的杂化轨道中,如果有孤对电子就是不等性的杂化,如果没有孤对电子,全部参与成键,则是等性的,据此可知PCl3、NH3、H2O、H2S中的P、N、O、S等均是不等性杂化,答案选A。?
点评:该题是中等难度的试题,主要是考查学生对分子杂化轨道类型的熟悉了解程度,难度不大。该题的关键是明确杂化轨道的不等性含义以及判断依据,然后结合具体的化学式灵活运用即可。
本题难度:一般
2、填空题 (1)原子轨道中相互重叠形成的________和_________总称价键轨道,是分子结构的价键理论中最基本的部分。
(2)σ键强度_________π键(填“>”“〈”或“=”)
(3)σ键的特征是:以形成_________的两原子核的连线为轴作旋转操作,共价键的电子云_________。
参考答案:(1)σ键;π键
(2)>
(3)共价键;图形不变
本题解析:
本题难度:一般
3、简答题 A、B、C、D、E、F是原子序数依次增大的六种短周期元素.F的单质在D2中燃烧的产物可使品红溶液褪色;B的单质在D2中燃烧可生成BD和BD2两种气体;E的原子序数为B的两倍;A元素的一种核素中不含中子.请回答下列问题:
(1)C的单质分子的结构式为______;ED的电子式为______.
(2)E单质在BD2中剧烈燃烧生成黑白两种固体,该反应的化学方程式为______.
(3)FD2气体通入BaCl2和HNO3的混合溶液中,生成白色沉淀和无色气体CD,有关反应的离子方程式为______,由此可知CD和FD2中还原性较强的是______(填化学式).
(4)A、C、D、F四种元素按原子个数比为5:1:4:1形成化合物甲,则甲的化学式为______.将0.01mol/L的甲溶液与0.03mol/L的Ba(OH)2溶液等体积混合得到沉淀,已知该沉淀的Ksp=x,则混合溶液中酸根离子的浓度为______mol/L(用含x的代数式表示,混合后溶液体积变化忽略不计).
参考答案:A、B、C、D、E、F是原子序数依次增大的六种短周期元素.F的单质在D2中燃烧的产物可使品红溶液褪色,则F为S元素,D为O元素;B的单质在D2中燃烧可生成BD和BD2两种气体,则B为C元素;C的原子序数介于碳、氧之间,则C为N元素;E的原子序数为B的两倍,则E为Mg;A元素的一种核素中不含中子,则A为H元素,
(1)C的单质为N2,分子N原子之间形成3对共用电子对,其结构式为N≡N;ED为MgO,由镁离子与氧离子构成,电子式为 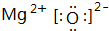 ,
,
故答案为:N≡N;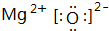 ;
;
(2)Mg在二氧化碳中燃烧生成碳与MgO,该反应的化学方程式为:2Mg+CO2点燃.2MgO+C,
故答案为:2Mg+CO2点燃.2MgO+C;
(3)SO2气体通入BaCl2和HNO3的混合溶液中,生成白色沉淀硫酸钡和无色气体NO,有关反应的离子方程式为:3SO2+3Ba2++2NO3-+2H来源:91考试 网2O=3BaSO4↓+2NO↑+4H+,由此可知,还原性NO<SO2,
故答案为:3SO2+3Ba2++2NO3-+2H2O=3BaSO4↓+2NO↑+4H+;SO2;
(4)H、N、O、S四种元素按原子个数比为5:1:4:1形成化合物甲,则甲的化学式为NH4HSO4,将0.01mol/L的NH4HSO4溶液与0.03mol/L的Ba(OH)2溶液等体积混合得到沉淀,氢氧化钡过量,反应后溶液中钡离子浓度约是:0.03mol/L-0.01mol/L2=0.01mol/L,硫酸钡的Ksp=x,根据溶度积表达式可知,溶液中硫酸根离子的浓度为:x0.01mol/L=100xmol/L,
故答案为:NH4HSO4;100x.
本题解析:
本题难度:一般
4、选择题 短周期的A、B两种元素,A原子半径小于B的原子半径,两种元素可形成A是正价的AB2型化合物.下列关于两元素的叙述正确的是( )
①A、B可能属于同一周期②A是B的前一周期元素;
③A只能是金属元素;?④A可能是第二周期IIA族或IVA族元素.
A.①③
B.②③
C.②④
D.②③④
参考答案:C
本题解析:
本题难度:一般
5、选择题 PCl3的结构类似于NH3,是一种三角锥形分子,下列有关叙述正确的是
A.PCl3分子中三个P-Cl键的键长、键能、键角都相等
B.PCl3分子中P原子采取sp3杂化,其中三个用于形成P-Cl键,另一个为空轨道
C.PCl3分子中的P原子的价层电子对数为3,孤电子对数为1
D.PCl3是由极性键构成的非极性分子
参考答案:A
本题解析:由VSEPR理论可知,PCl3分子中的P原子的价层电子对数为5,采取sp3杂化,其中三个用于形成P-Cl键,另一个含有一对孤电子,故它是由三个极性P—Cl键形成的极性分子,其中的三个极性键完全相同。答案为A
本题难度:一般