1、填空题 (12分)第一电离能I1是指气态原子X(g)处于基态时,失去一个电子成为气态阳离子X+(g)所需要的能量。下表是部分元素原子的第一电离能I1:(单位)
H
| ?
| ?
| ?
| ?
| ?
| ?
| He
|
1.3120
| ?
| ?
| ?
| ?
| ?
| ?
| 0.3723
|
Li
| Be
| B
| C
| N
| O
| F
| Ne
|
0.5203
| 0.8995
| 0.8001
| 1.0864
| 1.4023
| 1.3140
| 1.6810
| 2.0807
|
Na
| Mg
| Al
| Si
| P
| S
| Cl
| Ar
|
0.4958
| 0.7377
| 0.5776
| 0.7865
| 1.0118
| 0.9996
| 1.2511
| 1.5205
|
K
| Ca
| Ga
| Ge
| As
| Se
| Br
| Kr
|
0.4189
| 0.5898
| 0.5788
| ?
| 0.9440
| 0.9409
| 1.1399
| 1.3507
|
Rb
| Sr
| In
| Sn
| Sb
| Te
| I
| Xe
|
0.4030
| 0.5495
| 0.5583
| 0.7086
| 0.8316
| 0.8693
| 1.0084
| 1.1704
|
Cs
| Ba
| Tl
| Pb
| Bi
| Po
| At
| ?
|
回答下列问题:
(1)从表中数据可知,同一主族元素原子的第一电离能I1变化规律是 。说明同一主族元素 能力从上到下逐渐增强。
(2)从表中数据预测Ge元素第一电离能I1的最小范围?。
(3)SiC是原子晶体,其结构类似金刚石,为C、Si两原子依次相同排列的正四面体空间网状结构。如图为两个中心重合,各面分别平行的两个正方体,其中心为Si原子,试在小正方体的顶点画出与Si最近的C(用 表示)的位置,在大正方体的棱、顶、面等处画出相应Si(用
表示)的位置,在大正方体的棱、顶、面等处画出相应Si(用 表示)的位置。
表示)的位置。
参考答案:从上到下依次减小,失电子。?(2)0.7086—0.7865(3分)
(3)画对碳原子得1分,画对硅原子得2分。(共3分)
本题解析:(1)从表中数据可知,同一主族元素原子的第一电离能I1变化规律是从上到下依次减小,说明失电子的能力逐渐增强。
(2)同主族自上而下第一电离能逐渐减小,所以Ge的第一电离能大小范围是0.7086—0.7865。
(3)金刚石的中4个碳原子构成正四面体,所以小正方体中与Si最近的C原子位于四面体的4个顶点上,答案如图所示。
本题难度:一般
2、选择题 据最新报道,科学家发现了如下反应:O2+PtF6=O2(PtF6),已知O2(PtF6)为离子化合物,其中Pt的化合价为+5,对于此反应,下列说法正确的是
[? ]
A. 在此反应中,O2作氧化剂,PtF6作还原剂
B. O2(PtF6)中氧元素的化合价为+1
C. O2(PtF6)中不存在共价键
D. 每生成1 molO2(PtF6)则转移1mol电子
参考答案:D
本题解析:
本题难度:简单
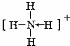
3、选择题 下列化学用语正确的是( )
A.聚丙烯的结构简式:
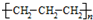
B.甲醛的电子式:
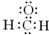
C.铵根离子的结构式:
D.甲酸甲酯的实验式:CH2O
参考答案:D
本题解析:
本题难度:一般
4、选择题 “笑气”(N2O)是人类最早应用于医疗的麻醉剂之一。下列说法合理的是
A.依据等电子原理N2O与SiO2分子具有相似的结构(包括电子式)
B.已知N2O分子中氧原子只与一个氮原子相连,则N2O的电子式可表示
C.N2O与CO2互为等电子体,因此不含非极性键
D.N2O为三角形分子
参考答案:B
本题解析:A不正确,N2O形成的晶体是分子晶体,二氧化硅是原子晶体;根据8电子的稳定结构可知,选项B中的电子式是正确的;C不正确,化合物中氮原子和氮原子之间存在非极性键;N2O与CO2互为等电子体,所以该化合物是直线型结构,D不正确,答案选B。
点评:该题是高考中的常见题型,属于中等难度试题的考查。试题难易适中,综合性强,存侧重对学生基础知识的巩固和训练有利于培养学生的逻辑推理能力和知识的迁移能力。
本题难度:简单
5、填空题 A+,B2+,C-离子都由1~18号中某些元素组成。A+离子中键角为109°28',B2+离子中没有化学键。C-离子中有9个质子,具直线型结构。已知A+,B2+,C-均有10个电子。试回答:
(1)写出离子符号:A+______,B2+______,C-______。
(2)下列微粒:Ca2+,Ag+,质子,中子,哪些最易与C-结合为挥发性稳定化合物______。
参考答案:(1)NH4+,Mg2+,OH-
(2)质子(即H+)
本题解析:
【错解分析】错解(1)Na+,Mg2+,F-?(2)Ag+或Ca2+
在中学化学里常见具有相同电子数的微粒有:
①具10电子的微粒:CH4,NH3,H2O,HF,Ne;Na+,Mg+,Al3+,N3-,O2-,F-,NH4+,H3O+,OH-等。
②具18电子的微粒:SiH4,PH3,H2S,HCl,Ar;K+,Ca2+,P3-,S2-,Cl-,HS-,O22-,F2,H2O2,C2H6,CH3OH,CH3F等。
【正解】由题给条件首先判断离子种类。有10个电子且有键角为109°28'的离子,必为五原子构成的正四面体构型的离子,只有NH4+符合题意。B2+为Mg2+无误。C-则不仅要由它有9个质子考虑,还要注意它有直线型构型,否则会误认为是F-。正确的应是OH-离子。至于与OH-结合为挥发性稳定化合物,则不注意易误写为HF,AgF,CaF2,后两者均不挥发。质子即指H+,它与OH-结合为水是合题意的。
本题难度:一般