1、选择题 下列说法中,正确的是( )
A.双原子分子中的共价键,一定是非极性键
B.任何原子的原子核都是由质子和中子构成的
C.非极性键也可能存在于离子化合物中
D.质子数相同的微粒,它们的化学性质基本相同
参考答案:A.双原子分子中的共价键也可能是极性键,如HF,故A错误;
B.氕中只有质子而没有中子,故B错误;
C.离子化合物中一定含有离子键,可能含有非极性键,如Na2O2,存在O-O非极性键,属于离子化合物,故C正确;
D.具有相同质子数的原子一定属于同种元素,但微粒可能为原子、分子、离子等,如Na+、NH4+的质子数都是11,HF、Ne的质子数都是10,但不是同种元素,化学性质不同,故D错误.
故选C.
本题解析:
本题难度:简单
2、填空题 有A、B、C、D、E五种短周期元素,已知A是构成化合物种类最多的元素,其原子最外层电子数是次外层电子数的2倍;E的最高正价和最低负价代数和为4;C与E同主族;B与D同主族;D+与氖原子具有相同的电子层结构;B元素原子的电子层数与族序数相等.试回答:
(1)元素符号:A______;B______;E______;
(2)写出C在元素周期表中的位置______;
(3)C、D、E原子半径由大到小的顺序是:______;(用元素符号表示)
(4)写出AC2的电子式:______;?B、C、D所形成的化合物的电子式______,并写出所含化学键的类型______;
(5)写出A和D两种元素的最高价氧化物发生氧化还原反应的化学方程式:______.
参考答案:(1)A是构成化合物种类最多的元素,其原子最外层电子数是次外层电子数的2倍,应为C元素,E的最高正价和最低负价代数和为4,则E为S元素,C与E同主族,应为O元素,D+与氖原子具有相同的电子层结构,则原子核外各层电子数分别为2、8、1,应为Na元素,B与D同主族,B元素原子的电子层数与族序数相等,应为H元素,
故答案为:C;H;S;
(2)C为O元素,原子核外有2个电子层,最外层电子数为6,则应位于第二周期第ⅥA族,故答案为:第二周期第ⅥA族;
(3)C为O元素,D为Na元素,E为S元素,Na与S位于同周期,同周期元素从左到右原子半径逐渐减小,则原子半径Na>S,
S比O元素多一个电子层,电子层数越多,半径越大,则半径S>O,所以原子半径Na>S>O,故答案为:Na>S>O;
(4)AC2对应的化合物为CO2,为共价化合物,电子式为
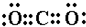
,B、C、D所形成的化合物为NaOH,为离子化合物,电子式为

,含有离子键和极性共价键,
故答案为:
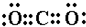
;

;离子键和极性共价键;
(5)A和D两种元素的最高价氧化物分别为CO2、Na2O2或Na2O,能发生氧化还原反应的为CO2和Na2O2,反应的化学方程式为2Na2O2+2CO2=2Na2CO3+O2,
故答案为:2Na2O2+2CO2=2Na2CO3+O2.
本题解析:
本题难度:简单
3、选择题 下列关于丙烯(CH3-CH=CH2)的说法正确的是
[? ]
A.丙烯分子有8个σ键,1 个π键
B.丙烯分子中3个碳原子都是sp3杂化
C.丙烯分子不存在非极性键
D.丙烯分子中3个碳原子可能在同一直线上
参考答案:A
本题解析:
本题难度:一般
4、选择题 下列选项错误的是
[? ]
A.在NH4Cl晶体中含有离子键和共价键
B.设想把“H2+ Cl2=2HCl”设计成燃料电池,用于工业制盐酸,并进行发电
C.某反应△H >0,△S >0,该反应是个非自发反应
D.25℃时,NaNO2溶液的pH =8,c(Na+) -c(NO2-)= 9.9×10-7mol/L
参考答案:C
本题解析:
本题难度:一般
5、选择题 用电子式表示化合物形成过程的下列各式中,正确的是
[? ]
A.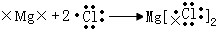
B.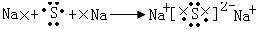
C.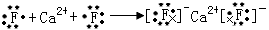
D.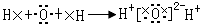
参考答案:B
本题解析:
本题难度:简单