1、选择题 为了研究氯水能否和碳酸钙发生化学反应,某学生设计如下实验:
实验一:向盛有饱和氯水的锥形瓶中加入大理石,并充分振荡,观察到氯水的黄绿色褪去并同时产生少量气体。
实验二:取上述实验一后锥形瓶中清液,进行如下实验:
①该清液滴在有色布条上有极强的漂白作用。②该清液中滴加碳酸钠溶液产生白色沉淀。③该清液中滴加盐酸可产生大量气体。④该清液加热后变浑浊并产生大量气体。
回答下列问题:
(1)在实验二中,清液滴在有色布条上有极强的漂白作用说明该清液中含有______________(写化学式);清液中滴加碳酸钠溶液产生白色沉淀说明该清液中含有______离子;清液中滴加盐酸产生的气体是________;清液加热后产生浑浊的原因是因为生成了________。
(2)该学生通过上述实验,写出氯水和碳酸钙反应的化学方程式为:
?。
参考答案:(1)HClO? Ca2+?CO2? CaCO3 (每空1分)
(2)2CaCO3+2Cl2+2H2O=Ca(HCO3)2+2HClO+CaCl2(2分)
本题解析:(1)氯水中具有漂白性的物质是HClO;能够与碳酸钠反应生成的白色沉淀为碳酸钙,可得清夜中含Ca2+;根据反应物可得出滴加盐酸产生的气体是CO2;清液加热后产生浑浊发生的反应为Ca(HCO3)2分解生成了CaCO3。
(2)根据(1)中现象可得出反应的产物有Ca(HCO3)2、2HClO、CaCl2,推出反应化学方程式。
本题难度:一般
2、填空题 A、C、E是中学化学中常见的单质,A是固体,C、E是无色无味的气体,D是黑色晶体,它们之间的转化关系如下图所示。
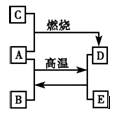
(1)写出A、B、C的化学式:
A___________________;B_________________;C______________。
(2)写出A、B转化为D、E的化学方程式_____________________________________。
(3)写出A与足量稀硝酸反应的离子方程式___________________________________。
参考答案:(1)(1分×3=3分)Fe;H2O;O2
(2)(2分)3Fe+4H2O Fe3O4+4H2↑
Fe3O4+4H2↑
(3)(2分)Fe+4H++NO3-==Fe3++NO↑+2H2O
本题解析:略
本题难度:简单
3、填空题 金刚石、SiC具有优良的耐磨、耐腐蚀特性,应用广泛。
(1)碳与短周期元素Q的单质化合仅能生成两种常见气态化合物,其中一种化合物R为非极性分子。碳元素在周期表中的位置是____________,Q是____________,R的电子式为________。
(2)一定条件下,Na还原CCl4可制备金刚石。反应结束冷却至室温后,回收其中的CCl4的实验操作名称为________,除去粗产品中少量钠的试剂为________。
(3)碳还原SiO2制SiC,其粗产品中杂质为Si和SiO2。现将20.0 g SiC粗产品加入到过量的NaOH溶液中充分反应,收集到0.1 mol氢气,过滤得SiC固体11.4 g,滤液稀释到1 L。生成氢气的离子方程式为__________________________________,硅酸盐的物质的量浓度为_________。
(4)下列叙述正确的有________(填序号)。
①Na还原CCl4的反应、Cl2与H2O的反应均是置换反应
②水晶、干冰熔化时克服粒子间作用力的类型相同
③Na2SiO3溶液与SO3的反应可用于推断Si与S的非金属性强弱
④钠、锂分别在空气中燃烧,生成的氧化物中阴阳离子数目比均为1:2
参考答案:(1)第二周期第ⅣA族氧(或O)
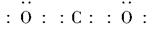
(2)过滤 水(或乙醇)
(3)Si+2OH-+H2O=SiO32-+2H2↑0.17 mol·L-1
(4)③④
本题解析:(1)由题意可知Q为O(氧),形成的化合物R为CO2,其电子式为: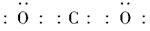 。(2)因为CCl4为液体,C和Na都为固体,所以用过滤法分离;除去C(金刚石)中的Na可以用水或乙醇。(3)混合物中的Si可以与NaOH溶液反应生成氢气,离子方程式为Si+2OH-+H2O=SiO32-+2H2↑。由于杂质SiO2也能生成Na2SiO3,所以可先求混合物中SiO2的质量,再求硅酸盐的物质的量浓度。
。(2)因为CCl4为液体,C和Na都为固体,所以用过滤法分离;除去C(金刚石)中的Na可以用水或乙醇。(3)混合物中的Si可以与NaOH溶液反应生成氢气,离子方程式为Si+2OH-+H2O=SiO32-+2H2↑。由于杂质SiO2也能生成Na2SiO3,所以可先求混合物中SiO2的质量,再求硅酸盐的物质的量浓度。
Si~ 2H2
28 g?2 mol
1.4 g?0.1 mol
m(SiO2)=20.0 g-11.4 g-1.4 g=7.2 g
n(SiO2)=0.12 mol
所以n(Na2SiO3)=n(Si)+n(SiO2)=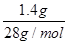 +0.12 mol=0.17 mol
+0.12 mol=0.17 mol
c(Na2SiO3)= =0.17 mol·L-1。
=0.17 mol·L-1。
(4)①中Cl2与H2O的反应不是置换反应;②中水晶熔化克服的是共价键,干冰熔化克服的是分子间作用力,两者不同;③④说法正确。
本题难度:一般
4、选择题 下列说法中,正确的是( )
A.亚硫酸钠溶液中加入氯化钡溶液后产生白色沉淀,再加稀盐酸沉淀不消失
B.正常雨水的pH等于7,pH小于7的雨水就是酸雨
C.二氧化硫能使品红溶液褪色,溶液受热后,溶液又变为红色
D.纯净的Cl2呈黄绿色,干燥的Cl2可以漂白干燥的有色布条
参考答案:A.亚硫酸钠和氯化钡反应生成不溶性的亚硫酸钡,亚硫酸的酸性小于盐酸,所以亚硫酸钡和盐酸反应生成可溶性的氯化钡,故A错误;
B.正常的雨水中溶于二氧化碳,二氧化碳和水反应生成碳酸,碳酸电离出氢离子,正常雨水的pH等于5.6,小于5.6的雨水是酸雨,故B错误;
C.二氧化硫能和颜色物质反应生成无色物质而具有漂白性,但二氧化硫的漂白性不稳定,受热后又恢复原色,故C正确;
D.氯气是黄绿色气体,氯气没有漂白性,氯气和水反应生成的次氯酸有漂白性,所以干燥的Cl2不能漂白干燥的有色布条,故D错误;
故选C.
本题解析:
本题难度:一般
5、实验题 (9分)无水氯化铝是白色晶体,易吸收水分,在178℃升华,装有无水氯化铝的试剂瓶久置于潮湿空气中,会自动爆炸并产生大量白雾。氯化铝常作为有机合成和石油工业的催化剂,并用于处理润滑油等。工业上由金属铝和氯气作用或由无水氯化氢气体与熔融金属铝作用制得。






某课外兴趣小组在实验室中,通过下图装置制取少量纯净的无水氯化铝。
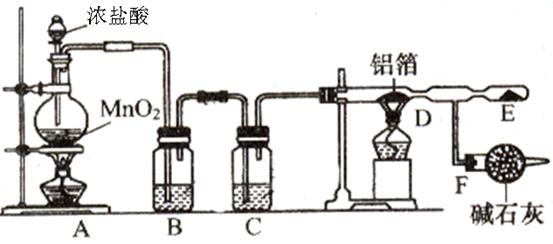 ?
?
(1)A装置中发生反应的化学方程式为?;
(2)B、C装置中应盛放的试剂名称分别为?、?;
(3)从A装置导出的气体若不经过B、C装置而直接进入D管,将对实验产生的不良后果是?;
(4)F装置所起的作用是?。
参考答案:
(1)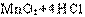 (浓)
(浓)
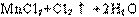 (2分)
(2分)
(2)饱和食盐水、浓硫酸(每空1分,共2分)
(3)未经除去的HCl和水蒸气随Cl2进入D 中(1分),和Al反应能生成H2(1分),H2和Cl2 混合会发生爆炸(1分)
(4)吸收多余的氯气,防止污染环境;防止空气中的水蒸气进入D中(2分)。
本题解析:略
本题难度:简单