1、选择题 下列实验操作后的混合物不能用加水过滤的方法进行分离的是
A.实验室用KClO3制取氧气所剩余的KCl和MnO2的混合物
B.实验室用稀盐酸和大理石反应制取CO2时,得到的CaCl2和大理石的混合物
C.某同学用氢气还原氧化铜来制取纯净的铜,由于最后操作不当而使还原生成的铜部分被氧化后剩余的混合物
D.用过量的Zn粉和稀H2SO4溶液来制取H2,最后剩余的混合物
参考答案:C
本题解析:过滤分离的要求是将易溶物和不溶物分离,CuO和Cu都属不溶物.
本题难度:困难
2、选择题 下列各组物质性质的比较不正确的是
A.熔点由高到低SiO2>CsCl>CBr4>CF4
B.热稳定性:HF>H2S>H2O
C.离子半径:O2->Na+>Mg2+
D.酸性:HClO4>H2SO4>H3PO4
参考答案:B
本题解析:略
本题难度:简单
3、填空题 (14分)下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
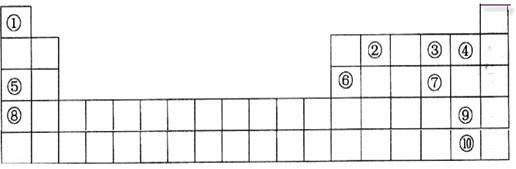
用化学符号回答下列问题:
(1)表中最活泼的金属与最活泼的非金属形成的物质是?;
(2)⑤、⑥、⑧的最高价水化物的碱性由强到弱的顺序是?;
③、④、⑦氢化物稳定性由强到弱的顺序是?;
(3)③与⑤按原子个数1:1所成的化合物的电子式为________________;该化合物与水反应的离子方程式为________________。
(4)⑥号元素最高氧化物水化物与⑤号元素最高价氧化物水化物反应的离子方程式为?;
(5)请设计一个实验方案,比较⑨、⑩的单质氧化性的强弱:?。
参考答案:(每空2)(1)KF(2)?KOH>NaOH>Al(OH)3?HF>H2O>H2S?
(3) ?2Na2O2+2H2O=4Na+ +4OH—+O2↑
?2Na2O2+2H2O=4Na+ +4OH—+O2↑
(4)Al(OH)3+OH- =AlO2-+2H2O
(5)将溴水加入碘化钠溶液中,再加入淀粉,若溶液变蓝,证明单质溴比单质碘氧化性强(其他合理答案也可)
本题解析:(1)表中最活泼的金属与最活泼的非金属分别是K和F,形成的化合物是KF。
(2)金属性越强,最高价氧化物的水化物的碱性越强。金属性是K>Na>Al,所以最高价水化物的碱性由强到弱的顺序是KOH>NaOH>Al(OH)3。非金属性越强,相应氢化物的稳定性越强,非金属性是F>O>S,所以相应氢化物的稳定性是HF>H2O>H2S。
(3)③与⑤按原子个数1:1所成的化合物是过氧化钠,其电子式为 。过氧化钠和水反应生成氢氧化钠和氧气,方程式为2Na2O2+2H2O=4Na+ +4OH—+O2↑。
。过氧化钠和水反应生成氢氧化钠和氧气,方程式为2Na2O2+2H2O=4Na+ +4OH—+O2↑。
(4)⑥号元素最高氧化物水化物与⑤号元素最高价氧化物水化物分别是氢氧化铝和氢氧化钠。由于氢氧化铝是两性氢氧化物,能和氢氧化钠反应,所以反应的方程式为Al(OH)3+OH- =AlO2-+2H2O。
(5)半径元素的非金属性强弱,可用非金属单质与盐溶液中简单阴离子之间的置换反应来验证,因为非金属性强的置换非金属性弱的。即将溴水加入碘化钠溶液中,再加入淀粉,若溶液变蓝,证明单质溴比单质碘氧化性强。
本题难度:一般
4、填空题 五种短周期元素的部分性质数据如下:
元素
| T
| X
| Y
| Z
| W
|
原子半径(nm)
| 0.037
| 0.075
| 0.099
| 0.102
| 0.143
|
最高或最低化合价
| +1
| +5
-3
| +7
-1
| +6
-2
| +3
|
(1)Z离子的结构示意图为?。
(2)关于Y、Z两种元素,下列叙述正确的是?(填序号)。
a.简单离子的半径 Y > Z
b.气态氢化物的稳定性Y比 Z强
c.最高价氧化物对应水化物的酸性Z比Y强
(3)甲是由T、X两种元素形成的10 e-分子,乙是由Y、W两种元素形成的化合物。
某同学设计了下图所示装置(夹持仪器省略)进行实验,将甲的浓溶液逐滴加入到NaOH固体中,烧瓶中即有甲放出,原因是?。一段时间后,观察到试管中的现象是?,发生反应的离子方程式是?。
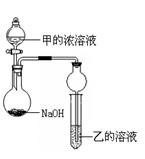
(4)XO2是导致光化学烟雾的“罪魁祸首”之一。它被氢氧化钠溶液吸收的化学方程式是:2XO2 + 2NaOH =" M" + NaXO3 + H2O(已配平),产物M中元素X的化合价为?。
参考答案:(1)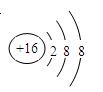
(2)b
(3)NH3+H2O NH3·H2O
NH3·H2O NH4++OH-,NaOH溶于水电离出OH-,使平衡向左移动,且溶解时放出热量,使NH3的溶解度减小
NH4++OH-,NaOH溶于水电离出OH-,使平衡向左移动,且溶解时放出热量,使NH3的溶解度减小
有白色沉淀生成
Al3++3NH3·H2O =Al(OH)3↓+3NH4+
(4)+3
本题解析:略
本题难度:一般
5、选择题 具有相同电子层结构的三种微粒An+、Bn-和C,下列分析正确的是( )
A.原子序数关系:C>B>A
B.微粒半径关系:r(Bn-)<r(An+)
C.微粒C是稀有气体元素的原子
D.原子半径关系是:r(A)<r(B)<r(C)
参考答案:C
本题解析:由题意知A属于金属,B属于非金属,C属于稀有气体。BC属于同一周期,A位于下一周期,故原子序数为A>C>B,所以微粒半径是r(Bn-)>r(An+),原子半径是r(A)>r(B)。因为稀有气体的原子半径与其它原子的测定原理不同,故和其它原子不具有可比性。因此答案是C。
本题难度:简单