1、填空题 (10分)T、X、Y、Z是中学化学常见的四种短周期元素,原子序数依次增大,其结构或性质信息如下表:
元素
| 结构或性质信息
|
T
| 基态原子的L层上s电子数等于p电子数
|
X
| 基态原子最外层未成对电子数在该元素所在周期中最多
|
Y
| 基态原子的第一电离能在该元素所在周期中最小
|
Z
| 单质常温、常压下是气体。基态原子的M层上有1个未成对p电子
|
请根据信息回答有关问题(用具体元素符号或化学式作答)
(1)T、X、Y三种元素的电负性由大到小的顺序是?。
(2)写出元素Z基态原子的电子排布式?。
(3)X的氢化物分子间能形成氢键,Z的氢化物分子间不易形成氢键,试分析原因是?。
(4)分子HTX中,有?个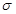 键,?个
键,?个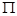 键。
键。
参考答案:(1)N > C > Na,?(2)1S22S22P63S23P5,
(3)N的电负性较大,而原子半径较小,?(4)2,2
本题解析:根据元素的结构及有关性质可知,T、X、Y、Z分别是C、N、Na、Cl。
(1)非金属性越强,电负性越大,因此是N > C > Na。
(2)根据构造原理可知,Cl元素基态原子的电子排布式为1S22S22P63S23P5。
(3)由于N的电负性较大,而原子半径较小,所以氮元素能形成氢键,而氯元素不能。
(4)该物质是HCN,其中H和C之间形成的是单键,C和N之间是三键。三键是由1个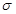 键和2个
键和2个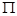 键构成的,所以该分子中含有个
键构成的,所以该分子中含有个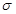 键,2个
键,2个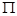 键。
键。
本题难度:一般
2、选择题 甲、乙、丙、丁四种元素位于同一短周期,原子序数依次增加。下列判断错误的是
A.原子半径:丙<乙<甲
B.若甲、乙、丙、丁的单质在常温下均为气态,则核电荷数比甲少1的元素形成的单质熔点可能很高。
C.若甲、乙、丙均是金属,则氢氧化物碱性:甲<乙<丙
D.若乙的最高价含氧酸为强酸,则丙是活泼非金属元素
参考答案:C
本题解析:A、同一周期从左到右,半径减小,故A正确;
B、均为气态,比甲少1,可能为金刚石;
C、同一周期从左到右,金属性减弱,最高价氧化物对应水化物碱性减弱。
D、乙为强酸,可能为S或Cl,丙为P或S,为活泼非金属
本题难度:一般
3、选择题 X、Y、Z、W均为短周期元素,它们在周期表中相应位置如图所示,若Y原子的最外层电子数是内层电子数的3倍,下列说法中错误的是
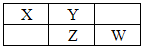
A.Y的气态氢化物的稳定性较Z的强
B.原子半径:W>Z>Y>X
C.W的最高价氧化物对应水化物的酸性较Z的强
D.四种元素的单质中,Z的熔、沸点最高
参考答案:B
本题解析:
答案:B
由题意X-N、Y-O、Z-S W-Cl,A、正确,从上到下氢化物稳定性增强;B不正确,原子半径从左到右应减小;Z>W,X>Y;C、正确,酸性HClO4>H2SO4,D正确,四种元素的单质中,S是固体,其余单质是气体。
本题难度:一般
4、选择题 已知X、Y和Z为第三周期元素,其原子的第一至第四电离能如下表:
电离能/kJ·mol—1
| I1
| I2
| I3
| I4
|
X
| 496
| 4562
| 6912
| 9543
|
Y
| 738
| 1451
| 7733
| 10540
|
Z
| 578
| 1817
| 2745
| 11578
|
则下列说法正确的是?(?)
A.电负性:? X﹥ Y ﹥ Z? B.单质中化学键的强弱:X ﹥ Y ﹥ Z
C.离子半径:X﹥ Y ﹥ Z? D.氧化物的晶格能:X ﹥Y ﹥Z
参考答案:C
本题解析:Z的I4电离能突然增大,说明最外层有3个电子,应为Al,Y的I3电离能突然增大,说明最外层有2个电子,应为Mg,?X的I2电离能突然增大,说明最外层有1个电子,应为Na,
A、不正确,同周期元素从左到右元素的电负性逐渐增强,电负性 :? X< Y < Z
B、不正确,单质中的金属键,从左到右元素逐渐增强,X< Y < Z
C、正确,电子层结构相同,核电荷越大离子半径越小;
D、不正确,离子半径越小,电荷越大,氧化物的晶格能越大:X< Y < Z;
选C。
本题难度:一般
5、选择题 下列关于能层与能级的说法中不正确的是(?)
A.原子核外电子的每一个能层最多可容纳的电子数为2n2
B.任一能层的能级总是从s能级开始,而且能级数等于该能层序数
C.同是s能级,在不同的能层中所能容纳的最多电子数是不相同的
D.1个原子轨道里最多只能容纳2个电子,但自旋方向相反。
参考答案:C
本题解析:同是s能级,在不同的能层中所能容纳的最多电子数是相同的,都是2个,选项C不正确,其余选项都是正确的,答案选C。
点评:该题是中等难度的试题,试题注重基础,侧重能力的培养的训练,有助于培养学生的逻辑思维能力和发散思维能力,提高学生分析问题、解决问题的能力。
本题难度:一般