1、选择题 X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如下图所示。若Y原子的最外层电子数是次外层电子数的3倍,下列说法中正确的是?( ?)
A.原子半径: W>Z>Y>X
B.最高价氧化物对应水化物的酸性:Z>W>X?
C.气态氢化物的稳定性:Z>W
D.W的单质能与水反应,生成一种具有漂白性的物质
2、填空题 下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。
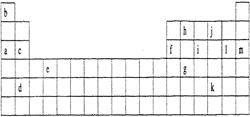
(1)下列?(填写编号)组元素的单质可能都是电的良导体。
①a、c、h?②b、g、k?③c、h、1?④d、e、f
(2)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去。核外电子离开该原子或离子所需要的能量主要受两大因素的影响:①原子核对核外电子的吸引力,②形成稳定结构的倾向。下表是一些气态原子失去核外不同电子所需的能量(kJ·mol-1):
?
| 锂
| X
| Y
|
失去第一个电子
| 519
| 502
| 580
|
失去第二个电子
| 7296
| 4570
| 1820
|
失去第三个电子
| 11799
| 6920
| 2750
|
失去第四个电子
| ?
| 9550
| 11600
|
①通过上述信息和表中的数据分析为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量:?。
②表中的X可能为以上13种元素中的?(用字母序号填写)元素,这种元素和j形成的化合物中若存在共价键,则该化合物的电子式是?,这种物质属于?(填“离子”或“共价”)化合物。
③Y在周期表中是?族的元素。
④在以上13种元素中,?(用字母序号填写)元素原子失去核外第一个电子需要的能量最多。
3、填空题 (13分)X、Y、Z、W是周期表前四周期中的常见元素,它们的原子序数依次增大,其相关信息如下表:

请根据以上信息回答下列问题:
(1)X元素所在族中的两种短周期元素形成的原子晶体的化学式为?;其熔点比X、Y两元素形成的化合物的熔点?(填“高”或“低”)。
(2)Z元素与Y元素所形成的原子个数比为1:1的化合物的电子式为?。
(3)W元素基态原子的价电子排布式为?;W或W的化合物,是中学化学课本中常见反应的催化剂,请写出其中一个用W或W的化合物做催化剂的化学反应的化学方程式:
?。
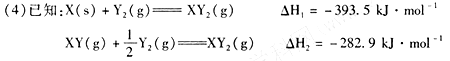
则X(s)与Y2(g)反应生成XY(g)的热化学反应方程式为:?。
4、选择题 若aAm+与bBn-的核外电子排布相同,则下列关系不正确的是?
A.a =" b+" m + n? B.离子半径Am+<Bn-
C.原子半径A>B?D.A、B一定都是短周期元素
5、填空题 (14分)下表由元素周期表的前三周期去掉副族上方的空白区域后组合而成,表中虚线处为ⅡA、ⅢA族的连接处。请用相应的化学用语回答下列问题:
?(1)上述标出的8种元素中金属性最强的是?,非金属性最强的是?。(填元素符号)
(2)e元素名称为?,位于第?周期?族。
(3)h的单质能与g元素的最高价氧化物对应的水化物的溶液反应,请写出该反应的离子方程式?。
(4)g 和e形成的化合物g2e2是?化合物(填“离子”或“共价”),其电子式为_?_。
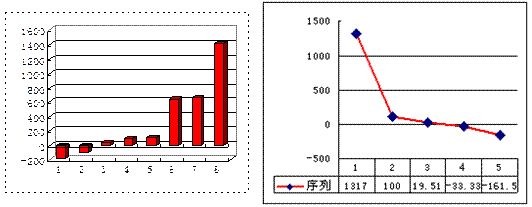
(5)上左图是表示第三周期8种元素单质的熔点(℃)柱形图,已知柱形“1”代表Ar,则其中柱形“8”代表Si,则其中柱形“2”代表?。(填化学式)
(6)b、c、d、e、f的氢化物的沸点(℃)直角坐标图(上右图),序列“5”的氢化物的名称是?,序列“2”的氢化物的结构式为?。