1、选择题 下列叙述正确的是?
A.提出原子结构模型的科学家按时间先后依次是:道尔顿、卢瑟福、汤姆生、玻尔
B.氯气是瑞典化学家舍勒发现的
C.海水中含有丰富的碘元素,因此碘被称为“海洋元素”
D.溴化银可用于人工降雨
参考答案:B
本题解析:A:顺序依次为:道尔顿、汤姆生、卢瑟福、玻尔
B:正确
C:溴为海洋元素
D:碘化银常用于人工降雨
故答案为B
本题难度:简单
2、选择题 为了建设资源节约型、环境友好型社会,节能减排将成为我国政府目前工作的重点,以下措施中不能体现这一思想的是?
A.在电解铝工业中添加冰晶石
B.研制出性能优良的催化剂,降低反应所需温度
C.开发太阳能、风能、氢能等清洁能源
D.大力发展火电,缓解用电紧张
参考答案:D
本题解析:
答案:D
A、正确,在电解铝工业中添加冰晶石,降低熔化温度;
B.正确,研制出性能优良的催化剂,降低反应所需温度,减少能耗;
C.正确,开发太阳能、风能、氢能等清洁能源减少化石燃料的使用;?
D.不正确,大力发展火电,增加CO2的排放,还可能产生SO2污染空气。
本题难度:一般
3、填空题 氨基磺酸(H2NSO3H)是一元固体强酸,溶于水和液氨,不溶于乙醇。在工业上用作酸性清洗剂、阻燃剂、磺化剂。用尿素[CO(NH2)2]和发烟硫酸(溶有SO3的硫酸)为原料合成氨基磺酸的路线如下:
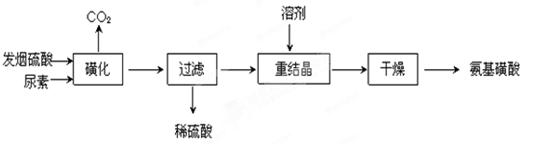
(1)重结晶用10%~12%的硫酸作溶剂而不用水作溶剂的原因是______________
(2)“磺化”步骤中所发生的反应为:
①CO(NH2)2(s) + SO3(g) 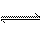 H2NCONHSO3H(s) △H<0
H2NCONHSO3H(s) △H<0
②H2NCONHSO3H + H2SO4 2H2NSO3H + CO2↑
2H2NSO3H + CO2↑
“磺化”过程应控制反应温度为75~80℃,若温度高于80℃,氨基磺酸的产率会降低,原因是_______________ 。
(3)测定产品中氨基磺酸纯度的方法如下:称取7.920g产品配成l000mL待测液,量取25.00mL待测液于锥形瓶中,加入2mL 0.2mol·L-1稀盐酸,用淀粉碘化钾试剂作指示剂,逐滴加入0.08000mol·L-1NaNO2溶液,当溶液恰好变蓝时,消耗NaNO2溶液25.00mL,此时氨基磺酸恰好被完全氧化成N2,NaNO2的还原产物也为N2。试求产品中氨基磺酸的质量分数?。
(4)以酚酞为指示剂,用NaOH进行酸碱中和滴定也能测定产品中氨基磺酸的纯度,测定结果通常比NaNO2法偏高,原因是氨基磺酸中混有___________杂质。
参考答案:(1)氨基磺酸在硫酸溶液中的溶解度比在水中的溶解度小。(2分)
(2)温度高,SO3气体逸出加 快
快 ,使反
,使反 应①转化率降低。温度高,反应①平衡向逆反应方向移动。(2分)
应①转化率降低。温度高,反应①平衡向逆反应方向移动。(2分)
(3)H2N SO3H+NaNO
SO3H+NaNO 2=NaHSO4+N2↑+H2O。或写出关系式H2NSO3H~NaNO2
2=NaHSO4+N2↑+H2O。或写出关系式H2NSO3H~NaNO2
n (H2NSO3H)=n(NaNO2)=25. 00×l0—3 × 0.08000 mol·L-1=2.000×l0—3 mol?ω(H2NSO3H)= 98.0%
mol·L-1=2.000×l0—3 mol?ω(H2NSO3H)= 98.0% (4分)
(4分)
(4)硫酸?(2分)
本题解析:略
本题难度:一般
4、选择题 下列说法中不正确的是( )。
A.金属的冶炼原理,就是运用氧化还原反应原理,在一定条件下将金属从其化合物中还原出来
B.冶炼金属时,必须加入一种物质作还原剂
C.金属由化合态变为游离态,一定是被还原
D.金属单质被发现和应用的越早,其活动性越弱
参考答案:B
本题解析:金属的冶炼就是把金属从其化合物中还原出来;有些金属冶炼时不需要还原剂,例如:Hg和Ag的冶炼,工业上用热分解法使HgO和Ag2O分解来获得Hg和Ag;金属在化合态中显正价,变成游离态化合价降低,被还原;金属活动性越弱,金属的获取越容易,金属单质被发现和应用的越早。
本题难度:一般
5、选择题 下列反应原理不符合工业冶炼金属实际情况的是
A.2HgO 2Hg+O2↑
2Hg+O2↑
B.4Al+3MnO2 2Al2O3+3Mn
2Al2O3+3Mn
C.2AlCl3 2Al+3Cl2 ↑
2Al+3Cl2 ↑
D.4CO+Fe3O4 3Fe+4CO2
3Fe+4CO2
参考答案:C
本题解析:A、不活泼金属如银、汞等采用热分解法制备,正确;B、熔点高的金属采用铝热反应制备,正确;C、工业采用电解氧化铝制备金属铝,错误;D、较活泼金属采用热还原的方法制备,正确。
本题难度:一般