1、选择题 下列不属于传统硅酸盐产品的是
[? ]
A.玻璃
B.水泥
C.光导纤维
D.陶瓷
参考答案:C
本题解析:
本题难度:简单
2、实验题 现代炼锌的方法可分为火法和湿法两大类,镉是生产硫酸锌的副产品,属于高毒性金属,试回答下列相关问题.
火法炼锌是将闪锌矿(主要含ZnS)通过浮选、焙烧使它转化为氧化锌,再把氧化锌和焦炭混合,在鼓风炉中加热至1373-1573K,使锌蒸馏出来。主要反应为:
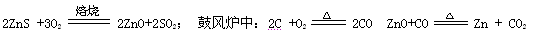
从火法炼锌蒸馏后的残渣中含多种金属单质及In2O3,可用硫酸提取铟,某研究机构对此研究数据如下。实验中涉及的酸度(每升溶液中含硫酸的质量)与铟的浸出率如下图1;硫酸溶液的体积与固体的体积比如图2
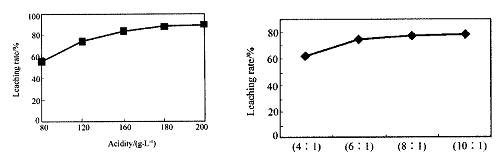
图1酸度对铟浸出率的影响?图2液固比对铟浸出率的影响
①当酸度为196时,其物质的量浓度为?。
②从节约原料和浸出率考虑,适宜的酸度和液固比分别为:_______、_______。
(2)湿法炼锌的主要工艺流程为:

①从保护环境和充分利用原料角度,如何处理或利用烟气?。
②除去酸浸出液中的铁,可用H2O2氧化,再调节pH使之形成Fe(OH)3沉淀,写出H2O2氧化Fe2+的离子方程式?
③酸浸出液还含有Cd2+,为了防止镉污染并回收镉,根据它们性质的差异,可用氢氧化钠溶液分离,已知Zn(OH)2和氢氧化铝一样也具有两性,试写出分离的离子方程式____________________、_______________。
参考答案:
(1)①2mol/L(3分)② 180(2分);6∶1(2分)
(2)①将烟道气净化,用于生产硫酸等。(2分)②2Fe2+ +H2O2 +2H+ = 2Fe3+ +2H2O(2分)
③Cd2+ + 2OH-=Cd(OH)2↓(2分),Zn2++4OH-=ZnO22-+2H2O[或Zn2++4OH-= Zn(OH)42-]。(2分)
本题解析:(1)①酸度为196,即196g/L,其物质的量浓度为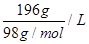 =2mol/L
=2mol/L
②从图像可看出:当酸度>180、液固比>6/1时,铟的浸出率保持在一定的水平,上升不再明显
(2)①烟气的主要成分为SO2,可净化、富集后制取硫酸
②根据化合升降守恒、电荷守恒及原子守恒,可配制此离子反应:2Fe2+ +H2O2 +2H+ = 2Fe3+ +2H2O
③Cd2+离子与OH—全部沉淀:Cd2+ + 2OH-=Cd(OH)2↓,而Zn2+可与OH—生成沉淀后,沉淀溶于过量的碱液中:Zn2++2OH-=Zn(OH)2↓? Zn(OH)2+2OH-=ZnO22-+2H2O(或Zn2++4OH-=ZnO22-+2H2O、Zn2++4OH-= Zn(OH)42-)
本题难度:一般
3、填空题 (7分)二氧化锰是制造锌锰干电池的基本材料.工业上以软锰矿为原料,利用硫酸亚铁制备高纯二氧化锰的流程如下:
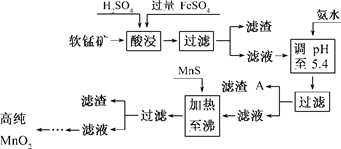
某软锰矿的主要成分为MnO2,还含Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物.部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表,回答下列问题:
沉淀物
| pH
|
Al(OH)3
| 5.2
|
Fe(OH)3
| 3.2
|
Fe(OH)2
| 9.7
|
Mn(OH)2
| 10.4
|
Cu(OH)2
| 6.7
|
Zn(OH)2
| 8.0
|
CuS
| ≥-0.42
|
ZnS
| ≥2.5
|
MnS
| ≥7
|
FeS
| ≥7
|
(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式为______________________________.
(2)滤渣A的主要成分为________.
(3)加入MnS的目的是除去________杂质.
(4)碱性锌锰干电池中,MnO2参与的电极反应方程式为__________________________.
(5)从废旧碱性锌锰干电池中可以回收利用的物质有________(写出两种).
参考答案:(1)MnO2+2FeSO4+2H2SO4===MnSO4+Fe2(SO4)3+2H2O
(2)Fe(OH)3、Al(OH)3?(3)Cu2+、Zn2+
(4)MnO2+H2O+e-===MnOOH+OH-?(5)Zn、MnO2
本题解析:(1)根据FeSO4在反应条件下将MnO2还原为MnSO4,Fe2+被氧化为Fe3+,可以写其反应方程式2FeSO4+MnO2+2H2SO4===MnSO4+Fe2(SO4)3+2H2O。
(2)根据反应后滤液(Mn2+、Fe3+、Al3+、Cu2+、Zn2+、Fe2+)加氨水调pH至5.4,结合题表可知滤渣A的主要成分为Fe(OH)3和Al(OH)3。
(3)根据题表可知加入MnS是为了生成溶解度更小的CuS、ZnS而除去Cu2+、Zn2+.
(4)碱性锌锰干电池中Zn作负极,则MnO2作正极得电子.其电极反应式应为 MnO2+H2O+e-===MnOOH+OH-。
(5)从碱性锌锰干电池的原料可知,其废旧电池可回收利用的物质为锌和MnO2。
本题难度:一般
4、选择题 下列属于硅酸盐工业产品的是( )
A.水泥
B.晶体硅
C.沙子
D.陶瓷
参考答案:AD
本题解析:
本题难度:简单
5、填空题 (14分)草酸亚铁可用于合成锂电池的正极材料硅酸亚铁锂(Li2FeSiO4)等,其制备过程主要包括:
a.将硫酸亚铁铵(NH4)2Fe(SO4)2·6H2O晶体溶于适量蒸馏水,加入适量稀硫酸酸化。
b.将上述溶液煮沸,逐滴加入H2C2O4溶液,直至沉淀完全。
c.静置、倾去上层清液、过滤、洗涤、50℃以下烘干。试回答下列问题:
(1)配制(NH4)2Fe(SO4)2·6H2O溶液时,需加入少量稀硫酸,目的是?。
(2)将制得的产品(FeC2O4·2H2O)在氩气气氛中进行热重分析,结果如图(TG%表示残留固体质量占原样品总质量的百分数)。

①则A-B发生反应的化学方程式为:?。
②精确研究表明,B?-C实际是分两步进行的,每步释放一种气体,其中第一步释放的气体相对分子质量较第二步的小,试写出B-C两步反应的方程式:??、
?;
(3)Li2CO3、FeC2O4·2H2O和SiO2粉末均匀混合,在800℃. 的氩气中烧结6小时,即可制成硅酸亚铁锂。①合成硅酸亚铁锂的化学方程式为:?。
②该锂电池放电时的总反应式为LiFeSiO4+Li=Li2FeSiO4,写出相应的电极反应式:
正极?、负极?。
参考答案:(每空2分共14分)
(1)抑制Fe2+水解
(2)①FeC2O4·2H2O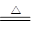 FeC2O4+2H2O
FeC2O4+2H2O
②FeC2O4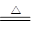 FeCO3+CO↑? FeCO3=FeO+CO2↑
FeCO3+CO↑? FeCO3=FeO+CO2↑
(3)Li2CO3+FeC2O4+SiO2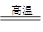 Li2FeSiO4+2CO2+2H2O
Li2FeSiO4+2CO2+2H2O
②LiFeSiO4+Li++e—==Li2FeSiO4 ?Li—e—=Li+
本题解析:(1)由于Fe2+易水解生成浑浊,故需要加入相应的酸抑制其水解
(2)在氩气环境中,二价铁不会被氧化;
①结晶水非常加热易失去,再结合图示数据可知AB段确为失去结晶水的过程:FeC2O4·2H2O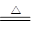 FeC2O4+2H2O
FeC2O4+2H2O
②结合FeC2O4所含有元素及加热所生成的气体只能为CO或CO2,由二者的分子量的大小可知,第一步分解过程中生成的为CO,而第二点分解得到的气体为CO2;
C点所得物质的分子量为:180×40%=72,恰好为FeO的式量;同时由于第二步有CO2的生成,可知第一步分解所得固体物质含碳及氧元素,则可判定为FeCO3
故两步反应分别为:FeC2O4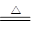 FeCO3+CO↑? FeCO3=FeO+CO2↑
FeCO3+CO↑? FeCO3=FeO+CO2↑
(3)①由元素的守恒、结合反应物及产物的组成、反应条件可综合判定,合成硅酸亚铁锂的化学方程式为:Li2CO3+FeC2O4+SiO2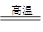 Li2FeSiO4+2CO2+2H2O
Li2FeSiO4+2CO2+2H2O
②由总反应可知,金属锂失电子,化合价生成,做负极:Li—e—=Li+;
由总反应减去负极反应可得正极反应式为:LiFeSiO4+Li++e—==Li2FeSiO4
本题难度:一般