1、选择题 下列叙述不正确的是( )
A.H2S、H2O、HF的稳定性依次增强
B.NaOH、KOH、Mg(OH)2的碱性依次减弱
C.Na、Mg、Al的半径依次减小
D.H2SiO3、H2CO3、H2SO4酸性依次增强
参考答案:A.非金属性:F>O>S,元素的非金属性越强,对应的氢化物越稳定,则H2S、H2O、HF的稳定性依次增强,故A正确;
B.金属性:K>Na>Mg,元素的金属性越强,对应的最高价氧化物的水化物的碱性越强,则KOH、NaOH、Mg(OH)2的碱性依次减弱,故B错误;
C.同周期元素从左到右原子半径逐渐减小,则Na、Mg、Al的半径依次减小,故C正确;
D.非金属性:S>C>Si,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,则H2SiO3、H2CO3、H2SO4酸性依次增强,故D正确.
故选B.
本题解析:
本题难度:一般
2、推断题 A、B、C、D、E、F均为短周期元素,且原子序数依次增大。A、E同主族,B、C 同周期且相邻,A、C的质子数之和等于D的质子数,A+与D2-的核外电子数之 和等于E+的核外电子数,C原子与E+的核外电子数之和等于F原子的核外电子数。试回答下列问题:
(1)C元素的原子结构示意图:____________。
(2)A、D、E、F的四种离子半径由大到小的顺序是(用离子符号表示)________________。
(3)写出BA4、D2与ADE构成的溶液形成燃料电池的负极反应方程式:________________
(4)A和D可组成原子个数比为1:1的化合物丙,将F的单质通往丙的水溶液中,生成一种强酸,且有气体放出。该反应的化学方程式是_________________。
(5)E和F可组成化合物丁。用惰性电极电解丁的水溶液一段时间后,假设生成的气体全部从体系中逸出,要使电解后的溶液完全复原,须向溶液中加入_________________ (填物质名称)。
参考答案:(1)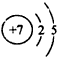 (2)Cl->O2->Na+>H+
(2)Cl->O2->Na+>H+
(3)CH4-8e-+10OH-=CO32-+7H2O
(4)Cl2+H2O2=2HCl+O2
(5)氯化氢
本题解析:
本题难度:一般
3、选择题 下列说法中正确的是( )
A.元素周期表中从ⅢB族到ⅡB族10列的元素都是金属元素
B.在元素周期表中金属与非金属的分界处,可以找到催化剂、耐高温材料
C.吸热反应中只有化学键断裂;
D.因为HCl溶于水后能电离出H+和Cl-,所以HCl属于离子化合物
参考答案:A.元素周期表中从ⅢB族到ⅡB族10列为过渡元素,过渡元素都是金属元素,故A正确;
B.在元素周期表中金属与非金属的分界处的元素既有金属性又有非金属性,可寻找半导体材料,故B错误;
C.因化学反应中一定有旧键断裂和新键生成,吸热反应中有旧键断裂和新键生成,故C错误;
D.电离与化合物的类别没有关系,HCl为共价化合物,溶于水电离产生离子,故D错误;
故选A.
本题解析:
本题难度:简单
4、填空题 X、Y、Z、W均为短周期元素,它们在周期表中的位置如图所示,若X、Y、Z的核外电子数之和为31,填写下列空白: X、Y、Z、W的元素名称分别为:
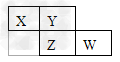
X__________,Y__________,Z_____________,W____________.
参考答案:氮 ;氧 ;硫 ;氯
本题解析:
本题难度:一般
5、选择题 下列说法中,正确的是( )
A.IA族元素的金属性一定比ⅡA族元素的金属性强
B.ⅦA族元素的非金属性是同周期元素中最强的
C.全部由非金属元素形成的化合物一定是共价化合物
D.短周期中,同周期元素的离子半径从左到右逐渐减小
参考答案:IA族元素的金属性不一定比ⅡA族元素的金属性强,如Ca的金属性比Na的强,但同周期的IA族元素的金属性一定比ⅡA族元素的金属性强,故A错误;
B.同周期从左向右非金属性增强,所以ⅦA族元素的非金属性是同周期元素中最强的,故B正确;
C.全部由非金属元素形成的化合物不一定是共价化合物,如铵盐为离子化合物,全部由非金属元素组成,故C错误;
D.短周期中,阳离子、阴离子的电子层结构相同时,原子序数大的离子半径小,如钠离子半径大于镁离子半径,故D错误;
故选B.
本题解析:
本题难度:简单