1、选择题 下列各装置的烧杯中都盛有海水,放置一定时间后,锌片的腐蚀速率由快到慢的是

A.①③②
B.①②③
C.②①③
D.③②①
2、填空题 已知草酸(H2C2O4)是一种二元弱酸,主要用作还原剂和漂白剂。
(1)草酸的电离方程式为 。
(2)将草酸溶液与酸性高锰酸钾溶液混合发生的反应为:
MnO4-+ H2C2O4+ → Mn2+ + CO2↑+ H2O
某合作小组同学在烧杯中进行上述反应时,发现刚开始一段时间,反应速率较慢,溶液褪色不明显,但不久后突然褪色,反应速率明显加快。
①配平上述离子方程式
②该实验不久后溶液突然褪色的原因最有可能是 。
A.体系压强增大 B.反应物接触面积增大
C.生成物对反应有催化作用 D.反应物浓度增大
(3)为研究该化学反应速率的影响因素,某同学进行了以下实验:
组别
| 温度/℃
| V(H2C2O4)
/mL
| V(KMnO4)
/mL
| V(H2O)
/mL
| KMnO4溶液
褪色时间/s
|
1
| 30
| 10
| 10
| 20
| 40
|
2
| 30
| 20
| 20
| 0
| t
|
3
| 30
|
|
| 15
|
|
①对比实验1和3要研究改变反应物浓度对化学反应速率的影响,请完成表格中横线。
②实验2中溶液褪色时间t 为
A.>40 B.=40 C.<40 D.无法判断
3、计算题 在一定温度和压强下,有如下反应:2SO2(g)+O2 (g)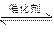 ?2SO3(g),将1.6 mol SO2和0.8 mol的O2放入一体积可变的密闭容器中,测得容器的起始容积为100 L。经一段时间后,反应达到平衡,测得混合气体的密度为1.6 g·L-1。完成下列问题:
?2SO3(g),将1.6 mol SO2和0.8 mol的O2放入一体积可变的密闭容器中,测得容器的起始容积为100 L。经一段时间后,反应达到平衡,测得混合气体的密度为1.6 g·L-1。完成下列问题:
(1)达平衡时混合气体的体积为___________,SO2的转化率为___________;
(2)若起始时加入a mol SO2、b mol O2,且a∶b=2∶1,在同样温度和压强下,反应达到平衡时,测得混合气体的容积为120 L。则a、b的值分别为:a=_________,b=_________;
(3)若容器为体积不变的密闭容器,其容积为100 L。起始时加入x mol SO2、y mol O2和z mol SO3,反应达平衡时,温度和压强与(2)完全相同,容器内各气体的体积分数也与(2)达平衡时的情况完全相同。则x、y应该满足的关系式为________,x、z应该满足的关系式为_____________。
4、选择题 现有下列四个图像

下列反应中全部符合上述图像的反应是
A.N2(g)+3H2(g)  2NH3(g);△H=-Q1 kJ/mol(Q1>0)
2NH3(g);△H=-Q1 kJ/mol(Q1>0)
B.2SO3(g)  2SO2(g)+O2(g);△H=+Q2 kJ/mol(Q2>0)
2SO2(g)+O2(g);△H=+Q2 kJ/mol(Q2>0)
C.4NH3(g)+5O2(g)  4NO+6H2O(g);△H=-Q3 kJ/mol(Q3>0)
4NO+6H2O(g);△H=-Q3 kJ/mol(Q3>0)
D.H2(g)+ CO(g)  C(s)+H2O(g);△H=+Q4 kJ/mol(Q4>0)
C(s)+H2O(g);△H=+Q4 kJ/mol(Q4>0)