1、填空题 (12分) 2SO2(g)+O2(g)? ? 2SO3(g),反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ/mol。
? 2SO3(g),反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ/mol。
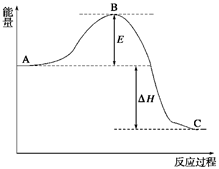
请回答下列问题:
(1) E的大小对该反应的反应热有无影响??。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低??;(2)图中ΔH=?kJ/mol;
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式?;
?;
(4)如果反应速率v(SO2)为0.05 mol/(L·min),则
 v(O2)=?mol/(L·min)、v(SO3)=?mol/(L·min);
v(O2)=?mol/(L·min)、v(SO3)=?mol/(L·min);
(5)已知S (s)+O2(g)? ?SO2(g) ΔH=-296 kJ/mol,计算由S(s)生成3 mol SO3(g)的ΔH?。
?SO2(g) ΔH=-296 kJ/mol,计算由S(s)生成3 mol SO3(g)的ΔH?。
参考答案:(1)没有影响 降低
(2)-198? (3)SO2+V2O5===SO3+2VO2,4VO2+O2===2V2O5?(4)0.025 0.05?
(5)-1 185 kJ/mol
本题解析:(1)由图像可知E代表活化能,和反应热无关。催化剂能降低反应的活化能,从而加快反应速率。
(2)1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ/mol,而方程式中二氧化硫是2mol,所以ΔH=-198 kJ/mol.
(3)根据所给元素化合价的变化可写出反应的方程式,SO2+V2O5===SO3+2VO2,4VO2+O2===2V2O5?。
(4)因为化学反应速率之比是相应的化学计量数之比,所以v(O2)=0.025mol/(L·min)、v(SO3)=0.05mol/(L·min).
(5)考查盖斯定律的应用。由反应① 2SO2(g)+O2(g) 2SO3(g)? ΔH=-198 kJ/mol和②S (s)+O2(g)
2SO3(g)? ΔH=-198 kJ/mol和②S (s)+O2(g) SO2(g)? ΔH=-296 kJ/mol联立即①+②×2得2S(s)+3O2(g)
SO2(g)? ΔH=-296 kJ/mol联立即①+②×2得2S(s)+3O2(g) 2SO3(g)? ΔH=-790 kJ/mol,所以由S(s)生成3 mol SO3(g)的ΔH=
2SO3(g)? ΔH=-790 kJ/mol,所以由S(s)生成3 mol SO3(g)的ΔH= 。
。
本题难度:简单
2、填空题 (12分)能源是人类生活和社会发展的基础,研究化学反应中的能量变化,有助于更好地利用化学反应为生产和生活服务。阅读下列有关能源的材料,回答有关问题:
(1)从能量的角度看,断开化学键要? _?,形成化学键要?。已知拆开1 mol H-H键、1 mol I-I、1 mol H-I键分别需要吸收的能量为436 kJ、151 kJ、299 kJ。则由氢气和碘反应生成1 mol HI需要? __?(填“放出”或“吸收”)? ___?kJ的热量。
(2)沼气是一种廉价能源,农村存在大量的秸秆、杂草等废弃物,它们经微生物发酵之后,便可产生沼气,可用来点火做饭。已知8g甲烷完全燃烧生成液态水时放出445.0kJ的热量,请写出甲烷燃烧热的热化学方程式____________________________________。
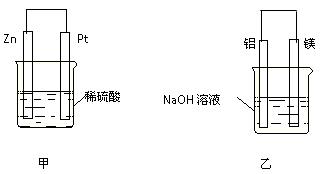
(3)在生产和生活中经常遇到化学能与电能的相互转化。
在如图甲、乙两装置中,甲中负极电极反应式为_____________________,
溶液中的阳离子向_____极移动(填“正”或“负”);乙中铝电极作__________极,发生______反应(填“氧化”或“还原”)。
参考答案:(12分)

本题解析:略
本题难度:简单
3、选择题 已知:①能量越低的物质就越稳定,②白磷转化成红磷是放热反应。据此,下列判断或说法中正确的是
A.在相同的条件下,红磷比白磷稳定
B.在相同的条件下,白磷比红磷稳定
C.红磷和白磷的结构相同
D.红磷容易发生自燃而白磷则不会自燃
参考答案:A
本题解析:
正确答案:A
A、正确,白磷转化成红磷是放热反应,说明红磷具有的能量低,在相同的条件下,红磷比白磷稳定。B、不正确;C、不正确,白磷的结构正确四面体,红磷为网状结构;D、不正确,白磷易自燃。
本题难度:一般
4、选择题 分析下表中的四个热化学方程式,判断氢气和丙烷的燃烧热分别是(?)
“嫦娥一号”发射火箭燃料
| 液氢(H2)
| ①2H2(g)+O2(g)=2H2O(l) △H=-571.6kJ·mol-1
②2H2(l)+O2(l)=2H2O(g) △H=-482.6kJ·mol-1
|
北京奥运会“祥云”火炬燃料
| 丙烷(C3H8)
| ③C3H8(l)+5O2(g)=3CO2(g)+4H2O(g)△H=-2013.8kJ·mol-1
④ C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)△H=-2221.5kJ·mol-1
|
A、571.6 kJ·mol-1,2221.5kJ·mol-1? B、241.3 kJ·mol-1,2013.8 kJ·mol-1
C、285.8 kJ·mol-1,2013.8 kJ·mol-1? D、285.8 kJ·mol-1,2221.5 kJ·mol-1
参考答案:D
本题解析:燃烧热的定义是1mol燃料完全燃烧生成稳定的化合物放出的热量,水应该生成液态水,故氢气的燃烧热应用②的反应热除以2算出1mol氢气燃烧放出的热量,丙烷应用反应④来求,故选D。
本题难度:一般
5、填空题 (9分)“西气东输”是西部开发的重点工程,这里的“气”是指天然气,其主要成分是甲烷。水煤气中主要成分是CO和H2,二者的体积比为l :l。已知:在120℃和一个大气压下,H-H键能为436 kJ/mol,O=O键能为496 kJ/mol,H-O键能为463 kJ/mol ;1 mol CO气体完全燃烧生成CO2气体放出283 kJ热量;l mol CH4气体完全燃烧生成CO2气体和气态水放出802 kJ热量。
(1)写出120℃和一个大气压下,H2完全燃烧生成气态水的热化学方程式?;
(2)相同条件下,若l mol CH4气体完全燃烧生成CO2气体和液态水,放出的热量?802 kJ;(选填“>”、“=”、“<”)
(3)忽略水煤气中其他成分,燃烧等体积的CH4和水煤气,所得热量之比约为?;
(4)请结合以上计算结果,叙述相比于水煤气,天然气作为燃料的两个优点:
?。
参考答案:(9分)
(1)2H2(g)+O2(g) = 2H2O(g)?△H= —484kJ·mol-1(3分,也可分数表示)
(2)>;(2分)
(3) 3.06(3.1)∶1 (2分)?(列式正确均给分如:802:(283+242)/2)
(4)燃烧等体积的气体产生的热量多;产生等量的热量CO2排放量少;CO有毒;以天然气代替水煤气有利于保护环境。(2分,答对2点即可,只答1点给1分,合理答案均给分)
本题解析:略
本题难度:简单