1、选择题 在下列反应中,生成物的能量总和高于反应物的能量总和的是
A.Zn(s)+CuSO4(aq)=ZnSO4(aq)+Cu(s) 放热反应
B.2CO(g)+O2(g)=2CO2(g) 放热反应
C.CaCO3(s)=CaO(s)+CO2 吸热反应
D.H+(aq)+OH-(aq)=H2O(l) 放热反应
参考答案:C
本题解析:只有C为吸热反应。
本题难度:简单
2、选择题 下列说法中,不正确的是
A.化学反应中既有物质变化又有能量变化
B.即使没有发生化学变化,也可能有能量的变化
C.任何化学反应中的能量变化都表现为热量变化
D.物质的化学能可以通过不同的变化方式转化为热能、电能等
参考答案:C
本题解析:化学反应中既有物质变化又有能量变化,故A正确;即使没有发生化学变化,也可能有能量的变化,例如水的蒸发,故B正确;化学反应中的能量变化一般表现为热量变化,也可以伴随着光能等的变化,所以C错误;物质的化学能可以通过不同的变化方式转化为热能、电能等,故D正确。所以答案为C。
点评:本题考查了化学的相关术语,是高考考查的重点,该题不难。
本题难度:简单
3、填空题 (15分)二甲醚(DME)和甲醇是21世纪应用最广泛的两种清洁燃料,目前工业上均可由合成气在特定催化剂作用下制得。
(1)由合成气制备二甲醚的主要原理如下:
已知:①CO(g)+2H2(g) CH3OH(g)? △H1=-90.7 kJ·mol-1
CH3OH(g)? △H1=-90.7 kJ·mol-1
②2CH3OH(g) CH3OCH3(g)+H2O(g)? △H2=-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g)? △H2=-23.5 kJ·mol-1
③CO(g)+H2O(g) CO2(g)+H2(g)? △H3=-41.2 kJ·mol-1
CO2(g)+H2(g)? △H3=-41.2 kJ·mol-1
则反应3H2(g)+3CO(g)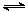 CH3OCH3(g)+CO2(g)的△H=?kJ·mol-1。
CH3OCH3(g)+CO2(g)的△H=?kJ·mol-1。
(2)将合成气以n(H2)/n(CO)=2通入1 L的反应器中,一定条件下发生反应:
4H2(g)+2CO(g)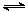 CH3OCH3(g)+H2O(g),其中CO的平衡转化率随温度、压强变化关系如图所示:
CH3OCH3(g)+H2O(g),其中CO的平衡转化率随温度、压强变化关系如图所示:
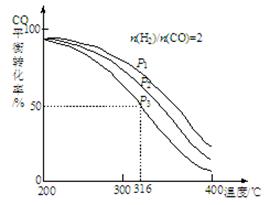
①该反应的平衡常数表达式为?;P1、P2、P3由大到小的顺序为?。
②若反应在P3和316℃时,起始时n(H2)/n(CO)=3,则达到平衡时,CO的转化率?50%(填“大于”、“小于”或“等于”)。
(3)由合成气合成甲醇的反应的温度与平衡常数(K)的关系如表数据,
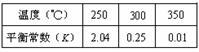
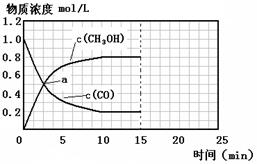
250℃时,将2 molCO和6 molH2充入2L的密闭容器中发生反应,反应时间与物质浓度的关系如图所示,则前10分钟内,氢气的平均反应速率为?;若15分钟时,只改变温度一个条件,假设在20分钟时达到新平衡,氢气的转化率为33.3%,此时温度为?(从上表中选),请在图中画出15—25分钟c (CH3OH)的变化曲线。
(4)利用甲醇液相脱水也可制备二甲醚,原理是:CH3OH +H2SO4→CH3HSO4+H2O,CH3HSO4+CH3OH→CH3OCH3+H2SO4。与合成气制备二甲醚比较,该工艺的优点是反应温度低,转化率高,其缺点是?。
参考答案:(1)-246.1;
(2)①K=[CH3OCH3][H2O]/ [H2]4[CO]2; P1>P2>P3;②大于;
(3)0.16mol/(L?min);300℃;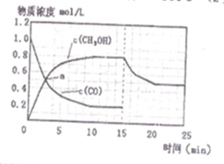 ;
;
(4)硫酸是强酸,具有较强的腐蚀性,能腐蚀设备。
本题解析:(1)①CO(g)+2H2(g) CH3OH(g)? △H1=-90.7 kJ·mol-1
CH3OH(g)? △H1=-90.7 kJ·mol-1
②2CH3OH(g) CH3OCH3(g)+H2O(g)? △H2=-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g)? △H2=-23.5 kJ·mol-1
③CO(g)+H2O(g) CO2(g)+H2(g)? △H3=-41.2 kJ·mol-1
CO2(g)+H2(g)? △H3=-41.2 kJ·mol-1
根据盖斯定律,①×2+②+③得3CO(g)+3H2(g) CH3OCH3(g)+CO2(g)△H=-246.1kJ?mol-1;(2)①根据反应4H2(g)+2CO(g)
CH3OCH3(g)+CO2(g)△H=-246.1kJ?mol-1;(2)①根据反应4H2(g)+2CO(g)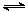 CH3OCH3(g)+H2O(g)知,该反应的平衡常数表达式K=[CH3OCH3][H2O]/ [H2]4[CO]2;该反应正方向为体积减小的方向,增大压强CO的转化率增大,结合题给图像知,P1>P2>P3;②若在P3和316℃时,起始时起始时n(H2)/n(CO)=3,则增大了氢气的量,增大氢气的浓度,平衡正移,CO的转化率增大,所以CO转化率大于50%;(3)由题给图像知,甲醇的浓度变化为0.8mol/L, V(CH3OH)=△c/△t=0.08mol/(L?min),根据方程式得V(CH3OH):V(H2)=1:2,所以V(H2)=2×0.08mol/(L?min)=0.16mol/(L?min);改变温度,假设在20分钟时达到新平衡,氢气的转化率为33.3%,则氢气转化的浓度为△C=3mol/L×33.3%=1mol/L,
CH3OCH3(g)+H2O(g)知,该反应的平衡常数表达式K=[CH3OCH3][H2O]/ [H2]4[CO]2;该反应正方向为体积减小的方向,增大压强CO的转化率增大,结合题给图像知,P1>P2>P3;②若在P3和316℃时,起始时起始时n(H2)/n(CO)=3,则增大了氢气的量,增大氢气的浓度,平衡正移,CO的转化率增大,所以CO转化率大于50%;(3)由题给图像知,甲醇的浓度变化为0.8mol/L, V(CH3OH)=△c/△t=0.08mol/(L?min),根据方程式得V(CH3OH):V(H2)=1:2,所以V(H2)=2×0.08mol/(L?min)=0.16mol/(L?min);改变温度,假设在20分钟时达到新平衡,氢气的转化率为33.3%,则氢气转化的浓度为△C=3mol/L×33.3%=1mol/L,
2H2(g)+CO(g)? CH3OH(g)
起始浓度(1mol/L)? 3? 1? 0
转化浓度(1mol/L)? 1?0.5? 0.5
平衡浓度(1mol/L)? 2?0.5?0.5
K=0.25,所以该温度为300℃;由反应CO(g)+2H2(g)?CH3OH(g)△H1=-90.7kJ?mol-1,该反应为吸热反应,温度升高平衡向移动,甲醇含量减小,图象见答案;(4)该反应有硫酸参加,因为硫酸是强酸,具有较强的腐蚀性,能腐蚀设备。
本题难度:一般
4、选择题 已知在相同条件下1mol正丁烷和1mol异丁烷完全燃烧生成CO2和液态水,放出的热量分别为2878KJ和2869KJ,则下列说法正确的是( )
A.正丁烷的稳定性大于异丁烷
B.正丁烷分子储存的能量大于异丁烷
C.异丁烷转化为正丁烷的过程是一个放热过程
D.异丁烷分子中的碳氢键比正丁烷多
参考答案:A、根据题意知,正丁烷的能量大于异丁烷的能量,能量越大,物质越不稳定,所以正丁烷的稳定性小于异丁烷的稳定性,故A错误.
B、根据能量守恒结合题意知,正丁烷的能量大于异丁烷的能量,故B正确.
C、根据题意知,正丁烷的能量大于异丁烷的能量,再根据能量守恒得,异丁烷转化为正丁烷的过程是一个吸热过程,故C错误.
D、正丁烷和异丁烷是同分异构体,所以含有的氢原子数相同,即碳氢键相同,故D错误.
故选B.
本题解析:
本题难度:一般
5、选择题 1gH2燃烧生成液态水放出142.9KJ的热量,表示该反应的热化学方程式正确的是(?)
A.2H2(g)+O2(g)=2H2O(l) ΔH=-142.9kJ·mol-1
B.2H2(g)+O2(g)=2H2O(l) ΔH=-571.6kJ·mol-1
C.2H2+O2=2H2OΔH=-571.6kJ·mol-1
D.H2(g)+1/2O2(g)=H2O(g)ΔH=-285.8kJ·mol-1
参考答案:B
本题解析:略
本题难度:一般