1、填空题 在80℃时,将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
时间(s)
C(mol/L)
|
0
|
20
|
40
|
60
|
80
|
100
|
C(N2O4)
| 0.20
| a
| 0.10
| c
| d
| e
|
C(NO2)
| 0.00
| 0.12
| b
| 0.22
| 0.22
| 0.22
|
反应进行至100s后将反应混合物的温度降低,发现气体的颜色变浅。
请回答下列问题:
(1)该反应的化学方程式为?,正反应是?(填“吸热”或“放热”)反应。
(2)20s时,N2O4的的浓度为?mol/L,0~20s内N2O4的平均反应速率为?。
(3)在80℃时该反应的平衡常数K值为?(保留2位小数)。
(4)在其他条件相同时,该反应的K值越大,表明建立平衡时?。
A、N2O4的转化率越高? B、NO2的产量越大
C、N2O4与NO2的浓度之比越大? D、正反应进行的程度越大
参考答案:(每空2分,共12分)(1)N2O4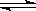 ?2NO2,吸热
?2NO2,吸热
(2)0.14, 0.003 mol/(L·s) (3)0.54 (4)ABD
本题解析:(1)N2O4分解生成NO2,反应的化学方程式是N2O4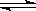 ?2NO2。根据表中数据可知,反应进行到60s时,物质到浓度不再发生变化,说明反应达到平衡状态。当反应进行到反应进行至100s后将反应混合物的温度降低,发现气体的颜色变浅,这说明降低温度反应写逆反应方向移动,因此正反应是吸热反应。
?2NO2。根据表中数据可知,反应进行到60s时,物质到浓度不再发生变化,说明反应达到平衡状态。当反应进行到反应进行至100s后将反应混合物的温度降低,发现气体的颜色变浅,这说明降低温度反应写逆反应方向移动,因此正反应是吸热反应。
(2)20s时,四氧化二氮的浓度为a
N2O4? ?2NO2
?2NO2
1mol/L?2mol/L
(0.20-a)mol/L ?0.12mol/L
解得a=0.14mol/L
则反应的N2O4浓度为(0.2-0.14)mol/L=0.06mol/L
则反应速率v(N2O4)=0.06mol/L÷20s=0.003 mol/(L·s)
(3)平衡时NO2当浓度是0.22mol/L,则N2O4的浓度是0.2mol/L-0.11mol/L=0.09mol/L
所以根据反应的方程式可知,平衡常数K=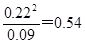
(4)根据化学平衡常数知,K越大,生成物的浓度越大,反应物的浓度越小,N2O4的转化率大、NO2的产量越大、N2O4与NO2的浓度之比越小、正反应进行的程度越大,即选项ABD正确,答案选ABD。
点评:该题是高考中的常见题型,属于综合性试题的考查。试题在注重对学生基础知识巩固和训练的同时,侧重对学生解题能力的培养和方法的指导与训练,旨在培养学生分析、归纳、总结问题的能力。有利于调动学生的学习兴趣和学习积极性,也有助于培养学生的逻辑推理能力和抽象思维能力。
本题难度:一般
2、选择题 一定条件下,向某密闭容器中加入一定量的N2和H2发生可逆反应:N2(g)+3H2(g) 2NH3(g) ΔH=-92.2 kJ·mol-1,测得0到10 s内,c(H2)减小了0.75 mol·L-1,下列说法正确的是( )
2NH3(g) ΔH=-92.2 kJ·mol-1,测得0到10 s内,c(H2)减小了0.75 mol·L-1,下列说法正确的是( )
A.10 s到15 s内c(NH3)增加量等于0.25 mol·L-1
B.10 s内氨气的平均反应速率为0.025 mol·L-1·s-1
C.达平衡后,分离出少量NH3,v正增大
D.该反应的逆反应的活化能不小于92.2 kJ·mol-1
参考答案:D
本题解析:由题,10 s内,v(H2)=0.75/10=0.075 mol·L-1·s-1,则v(NH3)=2v(H2)/3=0.5 mol·L-1·s-1,B错误;随反应的进行,正反应速率逐渐减小,故10 s到15 s内c(NH3)增加量减小,A项错误;达平衡后,分离出少量NH3,v正减小,C项错误;D项正确
本题难度:一般
3、选择题 某温度下,反应H2(g)+I2(g)?2HI(g);△H<0,在带有活塞的密闭容器中达到平衡,下列说法中正确的是( )
A.温度不变,压缩气体的体积,平衡不移动,混合气体颜色加深
B.温度、压强均不变,充人HI气体,开始时正反应速率增大
C.体积不变,升温正反应速率减小
D.体积、温度不变,充入氦气后,正反应速率将增大
参考答案:A.反应前后气体的化学计量数之和相等,压强对平衡移动没有影响,恒温,压缩体积,平衡不移动,但体积减小,浓度增大,所以颜色加深,故A正确;
B.恒压,充入HI(气),开始使反应物的浓度减小,则正反应速率减小,故B错误;
C.升高温度,正逆反应速率都增大,故C错误;
D.恒容恒温,充入惰性气体氦气,气体体积增大,压强减小平衡不移动,但反应速率减小,故D错误;
故选A.
本题解析:
本题难度:一般
4、选择题 COCl2(g) 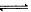 ?CO(g)+Cl2(g);△H>0。当反应达到平衡时,下列措施:①升温②恒容通入惰性气体③增加CO浓度④减压⑤加催化剂⑥恒压通入惰性气体,能提高COCl2转化率的是
?CO(g)+Cl2(g);△H>0。当反应达到平衡时,下列措施:①升温②恒容通入惰性气体③增加CO浓度④减压⑤加催化剂⑥恒压通入惰性气体,能提高COCl2转化率的是
[? ]
A.①②④
B.①④⑥
C.②③⑤
D.③⑤⑥
参考答案:B
本题解析:
本题难度:一般
5、选择题 在体积不变的密闭容器中,在一定条件下发生下列反应:2A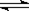 B(g)+C(s),达到平衡后,升高温度使容器内气体的密度增大,则下列叙述中正确的是( )
B(g)+C(s),达到平衡后,升高温度使容器内气体的密度增大,则下列叙述中正确的是( )
A.若正反应为吸热反应,则A为非气体
B.若正反应为放热反应,则A为非气体
C.在平衡体系中加入少量的C,该平衡向逆反应方向移动
D.改变压强对该平衡的移动无影响