1、填空题 有pH=4的盐酸、硫酸、醋酸三瓶溶液:(以下用>、<、=表示)
(1)设三种溶液的物质的量浓度依次为c1、c2、c3,则其关系是 。
(2)取相同体积的三种酸分别加入蒸馏水稀释到pH=6,需水的体积依次为V1、V2、V3,则其关系是 。
(3)完全中和体积和物质的量浓度均相同的Ba(OH)2溶液时,需三种酸的物质的量依次为n1、n2、n3,则其关系是 。
(4)取同体积的酸的溶液分别加入足量的锌粉,反应开始放出H2的速率依次为v1、v2、v3,则其关系是 ;反应过程中放出H2的速率依次为va、vb、vc,则其关系是 。
参考答案:(1)c2<c1<c3或c3>c1>c2
(2)V1=V2<V3
(3)n1=n3>n2
(4)v1=v2=v3 va=vb<vc
本题解析:盐酸是一元强酸,硫酸是二元强酸,醋酸是弱酸。由于醋酸中存在电离平衡,pH相同时,醋酸的物质的量浓度最大。同样原因,稀释时,促进了醋酸的电离,所需要的水比强酸多。
本题难度:一般
2、选择题 已知100℃时,0.01mol·L-1 NaHSO4溶液中水电离的c(H+)=10-10 mol·L-1,该温度下将pH=8的Ba(OH)2溶液V1 L与pH="5" V2 L NaHSO4混合,所得溶液pH=7,则 V1∶V2=
A.2∶9
B.1∶9
C.1∶1
D.1∶2
参考答案:A
本题解析:0.01mol·L-1 NaHSO4溶液中水电离的c(H+)=10-10 mol·L-1,说明溶液中OH-的浓度也是10-10 mol·L-1,氢离子浓度是0.01mol/L,所以该温度下水的离子积常数为1×10-12。所得溶液pH=7,说明溶液显碱性,即碱是过量的,所以有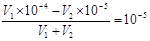 ,解得V1∶V2=2∶9,答案选A。
,解得V1∶V2=2∶9,答案选A。
本题难度:简单
3、选择题 MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如右图所示。下列叙述中正确的是

A.在x点时,ROH完全电离
B.在x点时,c(M+)>c(R+)
C.MOH是一种强碱
D.稀释前,c(ROH)=10c(MOH)
参考答案:A
本题解析:从图中可以看出,ROH稀释100倍,pH降低2,说明是强电解质,完全电离,A项正确;在x点时,pH值相等,则氢离子、氢氧根离子浓度相等,M离子和R离子浓度相等,B项错误;MOH不能完全电离,C项错误;因为MOH是弱电解质,大量没有电离,物质的量浓度大于0.01mol/L,不能确定c(ROH)与10c(MOH)的关系。
点评:通过图像要分析出是否稀释10倍,pH值下降1,来比较强弱电解质,属于简单题。
本题难度:一般
4、选择题 在相同温度时,100mL0.01mol/L的醋酸溶液与10mL 0.1mol/L的醋酸溶液相比较,下列数值中,前者大于后者的是
[? ]
A.H+的物质的量
B.醋酸的电离常数
C.中和时所需NaOH的量
D.CH3COOH的物质的量
参考答案:A
本题解析:
本题难度:一般
5、选择题 一定温度下,用水稀释0.1mol?L-1的一元弱酸HA,随稀释进行,下列数值一定增大的是(Kw表示水的离子积,Ka表示HA的电离常数)( )
A.Kw
B.
C.
D.c(OH-)
参考答案:A.温度不变,水的离子积常数不变,故A错误;
B.加水稀释促进弱酸电离,氢离子的物质的量增大,但溶液体积增大的倍数大于氢离子增大的物质的量,溶液氢原子浓度减小,温度不变,电离平衡常数不变,所以c(H+)Ka减小,故B错误;
C.加水稀释促进弱酸电离,所以酸分子个数减小,酸根离子个数增大,则c(HA)c(A-),故C错误;
D.加水稀释,溶液中氢离子浓度减小,温度不变,水的离子积常数不变,则氢氧根离子浓度增大,故D正确;
故选D.
本题解析:
本题难度:一般