1、选择题 在一定温度下,将1 mol N2和3 mol H2放入恒容密闭容器中,达到平衡时,测得NH3为0.8 mol,如果此时再加入1 mol N2和3 mol H2,达到新平衡时,NH3的物质的量
A.等于0.8 mol
B.等于1.6 mol
C.大于0.8 mol小于1.6 mol?
D.大于1.6 mol
2、计算题 (7分)某固定容积的2L密闭容器中进行反应 :?起始时加入的N2、H2、NH3均为2mol,5min后反应达到平衡, NH3的物质的量为3mol,求:
:?起始时加入的N2、H2、NH3均为2mol,5min后反应达到平衡, NH3的物质的量为3mol,求:
(1)这5分钟内用N2来表示该反应的反应速率(请写出计算过程,下同)
(2)求平衡时H2的物质的量浓度
(3)平衡时容器的压强为初始时的几分之几?
3、选择题 某温度下,在一个体积固定的密闭容器中,充入2?mol?NO和1?molO2,发生反应:2NO(g)+O2(g) 2NO2(g),一定条件下达到平衡,测得NO的转化率为80%(容器内温度不变),此时容器内压强与起始时压强之比为
2NO2(g),一定条件下达到平衡,测得NO的转化率为80%(容器内温度不变),此时容器内压强与起始时压强之比为
[? ]
A.11∶15 ? ?
B.小于11∶15?
C.5∶6 ?
D.大于5∶6
4、选择题 将一定量的固体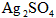 置于容积不变的密闭容器中(装有少量
置于容积不变的密闭容器中(装有少量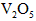 ),某温度下发生反应:
),某温度下发生反应:
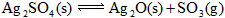 ,
,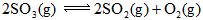 ,反应经过10min达到平衡,测得
,反应经过10min达到平衡,测得 ,
,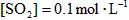 ,则下列叙述中不正确的是
,则下列叙述中不正确的是
[? ]
A.容器里气体的密度为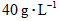
B.SO3的分解率为20%
C.在这10 min内的平均反应速率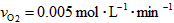
D.化学反应速率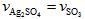
5、填空题 某研究小组对一元有机弱酸HA在溶剂苯和水的混合体系中的溶解程度进行研究。在25℃时,弱酸HA在水中部分电离,当HA浓度为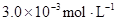 时,其电离度为0.20(电离度=已电离的HA分子数/起始HA的总分子数);在苯中部分发生双聚,生成(HA)2。该平衡体系中,一元有机弱酸HA在溶剂苯(B)和水(W)中的分配系数为K,K=C(HA)B/C(HA)W=1.0,即达到平衡后,以分子形式存在的HA在苯和水两种溶剂中的比例为1:1;其他信息如下:
时,其电离度为0.20(电离度=已电离的HA分子数/起始HA的总分子数);在苯中部分发生双聚,生成(HA)2。该平衡体系中,一元有机弱酸HA在溶剂苯(B)和水(W)中的分配系数为K,K=C(HA)B/C(HA)W=1.0,即达到平衡后,以分子形式存在的HA在苯和水两种溶剂中的比例为1:1;其他信息如下:
25℃平衡体系
| 平衡常数
| 焓变
| 起始总浓度
|
在水中,HA 
| 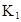
| 
| 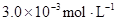
|
在苯中,2HA 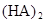
| 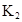
| 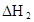
| 
|
?
回答下列问题:
(1)计算25℃时水溶液中HA的电离平衡常数K1=___________。
(2)25℃,该水溶液的pH为___________,(已知:1g2=0.3,lg3=0.5)在苯体系中HA的转化率为___________。
(3)在苯中,HA发生二聚:2HA (HA)2,反应在较低温度下自发进行,则
(HA)2,反应在较低温度下自发进行,则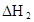 ___________0。
___________0。
(4)25℃混合体系中,HA在苯中发生二聚,若测得某时刻溶液中微粒浓度满足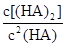 =130,则反应向___________方向进行。
=130,则反应向___________方向进行。