1、选择题 现有三组溶液(1)汽油和氯化钠溶液;(2)酒精和水的混合溶液;(3)氯化钠和单质溴的溶液.以上混合溶液分离的正确方法依次是
A.分液、萃取、蒸馏
B.萃取、蒸馏、分液
C.分液、蒸馏、萃取
D.蒸馏、萃取、分液
参考答案:C
本题解析:
本题难度:困难
2、选择题 四种主族元素的离子aXm+、bYn+、cZn-和dRm-(a、b、c、d为元素的原子序数),它们具有相同的电子层结构,若m>n,则对下列叙述的判断正确的是(?)
①a-b=m-n
②元素的原子序数a>b>c>d
③元素非金属性Z>R
④最高价氧化物对应水化物的碱性X>Y
A.②③
B.③
C.①②③④
D.①②③
参考答案:D
本题解析:金属元素的原子失去电子变为阳离子,非金属元素的原子获得电子变为阴离子。原子失去或获得的电子越多,其所带的电荷就越多。根据题意可得:①a-m=b-n ,整理可得a-b=m-n。正确。由于这几种离子的电子层结构相同,Xm+、bYn+是阳离子,失去的电子m>n,所以原子序数a>b;cZn-和dRm-是阴离子,得到的电子m>n,所以原子序数c>d.。阳离子的原子序数大于阴离子的原子序数。所以元素的原子序数a>b>c>d.正确。③同一周期的元素,原子序数越大,元素非金属性越强,由于Z的原子序数大于R的原子序数,所以非金属性Z>R。正确。④同一周期的元素,原子序数越大,元素的金属性就越弱。原子序数X>Y。所以最是高价氧化物对应水化物的碱性Y>X。错误。
本题难度:一般
3、填空题 (10分)短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T的单质既可与盐酸反应,又可与NaOH溶液反应,请回答下列问题:
(1)T的原子结构示意图为_______________。
(2)元素的非金属性为(原子的得电子能力):Q______ R (填“强于”或“弱于”)
3)、T的硫酸盐溶液与过量NaOH溶液反应的离子方程式为?。
4)请写出R与氢形成的氢化物的电子式?
5)、Q、R、T、W的原子半径由大到小的顺序为?
参考答案:(1)、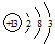 ?(2)、弱于?(3)、Al3++4OH- = AlO2-+2H2O
?(2)、弱于?(3)、Al3++4OH- = AlO2-+2H2O
(4)、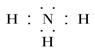 ?(5)、T>W>Q>R
?(5)、T>W>Q>R
本题解析:考查元素周期表的结构和元素周期律的应用。T的单质既可与盐酸反应,又可与NaOH溶液反应,所以T是铝,则根据元素在周期表中的位置可判断,Q是碳,R是氮,W是硫。
(1)铝位于第三周期第ⅢA,结构示意图为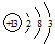 。
。
(2)同周期自左向右非金属性逐渐增强,所以碳的非金属性弱于氮的。
(3)氢氧化铝是两性氢氧化物,能溶于氢氧化钠溶液中,反应式为Al3++4OH- = AlO2-+2H2O。
(4)氮和氢都是非金属,形成的化学键是极性键,所以氨气的电子式为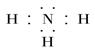 。
。
(5)同主族自上而下原子半径逐渐增大,同周期自左向右原子半径逐渐减小,所以原子半径大小顺序为T>W>Q>R。
本题难度:一般
4、选择题 下列分子中,中心原子以sp3杂化且属于极性分子的是
A.CCl4
B.BF3
C.CO
D.NH3
参考答案:D
本题解析:AB是非极性分子。CO中碳和氧形成双键,同时氧原子又提供1对电子对和碳形成配位键,所以选项C不符合题意。氨气中氮原子含有1对孤对电子,所以空间构型是三角锥形,属于极性分子,因此正确的答案是D。
本题难度:简单
5、选择题 原子序数从3~10的元素,随着核电荷数的递增而逐渐 增大
增大 的是
的是
A.电子层数
B.电子数
C.原子半径
D.化合价
参考答案:B
本题解析:略
本题难度:一般