1、选择题 下列现象或事实可用同一原理解释的是
A.铁在冷的浓硫酸中和铝在冷的浓硝酸中都没有明显变化
B.浓硫酸和浓盐酸长期暴露在空气中浓度降低
C.SO2、漂白粉、活性炭、过氧化钠都能使红墨水褪色
D.漂白粉和水玻璃长期暴露在空气中变质
参考答案:A
本题解析:A.铁在冷的浓硫酸中和铝在冷的浓硝酸中都没有明显变化,都是金属铁和铝的钝化现象;B.浓硫酸和浓盐酸长期暴露在空气中浓度降低,前者是吸水,后者是挥发,原理不同;C.使红墨水褪色SO2是化合反应,漂白粉、过氧化钠是氧化,活性炭是吸附;D.长期暴露在空气中:漂白粉是吸潮后与CO2生成HClO,然后分解而变质;水玻璃是直接与CO2反应生成Na2CO3和硅酸而变质。
本题难度:一般
2、选择题 把铁片放入下列溶液中铁片溶解,溶液质量增加,但没有气体放出的是
A.稀硫酸
B.CuSO4溶液
C.Fe2(SO4)3溶液
D.AgNO3溶液
参考答案:C
本题解析:铁是活泼的金属,和稀硫酸反应生成硫酸亚铁和氢气,溶液质量增加;和硫酸铜反应生成硫酸亚铁和单质铜,溶液质量减少;和硫酸铁反应生成硫酸亚铁,溶液质量增加;和硝酸银溶液反应生成硝酸亚铁和单质银,溶液质量减少,因此正确的答案选C。
点评:该题是中等难度的试题,侧重对学生基础知识的检验和训练,明确反应的原理,并能熟练形成有关反应的化学方程式是答题的关键,有利于培养学生的逻辑推理能力和发散思维能力。
本题难度:简单
3、实验题 合肥市某校化学兴趣小组为探究铁与浓硫酸反应,设计了如图所示装置进行实验。
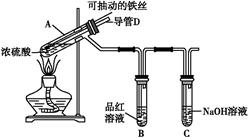
(1)实验过程中,观察到B中的实验现象是? 。
一段时间后,观察到从C中有少量的气泡冒出,此气泡的成分是 ?。
(2)用“可抽动的铁丝”代替“直接投入铁片”的优点是? ;
反应结束后,不需要打开胶塞,就可使装置中残留气体完全被吸收,应当采取的操作是? 。
(3)反应一段时间后,他们对A中溶液的金属阳离子进行了探究。
①提出假设:
假设1:溶液中只存在Fe2+;
假设2: ?;?
假设3:溶液中存在Fe2+和Fe3+。
②请你设计实验验证上述假设1,写出实验操作步骤、实验现象及结论。限选试剂:酸性KMnO4溶液、NaOH溶液、淀粉KI溶液、KSCN溶液。
?
参考答案:(1)品红溶液褪色 H2
(2)便于控制铁与浓硫酸的反应和停止 从D管口向A中鼓入大量的空气
(3)①溶液中只存在Fe3+
②
实验操作步骤
实验现象
结论
方法一:取少量A中溶液分别加入甲、乙两支试管中;甲中滴加少量酸性高锰酸钾溶液;乙中滴加少量KSCN溶液
甲中高锰酸钾溶液褪色;乙中KSCN溶液不变红
溶液中存在Fe2+,不存在Fe3+
方法二:取少量A中溶液加入试管中,滴入少量KSCN溶液,一段时间后再加入少量氯水
加入KSCN溶液不显红色,继续加入少量氯水,溶液显红色
溶液中不存在Fe3+,存在Fe2+
本题解析:(1)A中开始可能发生的反应有:2Fe+6H2SO4(浓) Fe2(SO4)3+3SO2↑+6H2O、Fe+Fe2(SO4)3
Fe2(SO4)3+3SO2↑+6H2O、Fe+Fe2(SO4)3 3FeSO4,随着反应的进行,浓硫酸变为稀硫酸,铁与稀硫酸反应产生氢气。
3FeSO4,随着反应的进行,浓硫酸变为稀硫酸,铁与稀硫酸反应产生氢气。
(2)将抽动的铁丝脱离液面,反应停止,将抽动的铁丝插入液面,反应开始;鼓入空气将试管内的气体排出。
(3)检验Fe2+时必须防止Fe3+的干扰,Fe3+与酸性高锰酸钾溶液不反应,而Fe2+具有较强的还原性,因此Fe2+能使酸性高锰酸钾溶液褪色,选择酸性高锰酸钾溶液。但必须还要证明溶液中不含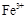 选用KSCN溶液。
选用KSCN溶液。
本题难度:一般
4、填空题 铜是生命必需的元素,也是人类最早使用的金属之一。铜的生产和使用对国计民生各个方面产生了深远的影响。在化学反应中,铜元素可表现的价态为0、+1、+2。
(1)在西汉古籍中曾有记载:曾青得铁则化为铜〔即曾青(CuSO4)跟铁反应生成铜〕。试写出该反应的离子方程式___________________________________________。
(2)尽管铜比铁较为稳定,但铜器表面经常会生成铜锈〔即铜绿,化学式:Cu2(OH)2CO3〕,其中生成铜绿的反应物除铜外还有O2、CO2和H2O。试写出保护铜制品的方法:_________________________。
(3)铜钱在历史上曾经是一种广泛流通的货币。试从物理性质和化学性质的角度分析为什么铜常用于制造货币。(铜的熔点是1183.4℃,铁的熔点是1534.8℃)
?。
参考答案:(1)Fe+Cu2+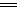 Fe2++Cu
Fe2++Cu
(2)干燥空气中保存
(3)铜的化学性质比较稳定,不易被腐蚀,铜的熔点比较低,容易冶炼铸造成型
本题解析:根据题目信息可知硫酸铜与铁反应的离子方程式为Fe+Cu2+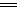 Fe2++Cu;由于铜在潮湿的空气中容易与CO2作用产生碱式碳酸铜,所以铜应保存在干燥的空气中。
Fe2++Cu;由于铜在潮湿的空气中容易与CO2作用产生碱式碳酸铜,所以铜应保存在干燥的空气中。
本题难度:简单
5、选择题 将适量铁粉投入三氯化铁溶液中,完全反应后,溶液中的Fe3+和Fe2+浓度相等,则已反应的Fe3+和未反应的Fe3+的物质的量之比是(? )
A.2∶3
B.3∶2
C.1∶2
D.1∶1
参考答案:A
本题解析:设原Fe3+为x,已反应的Fe3+为y,
2Fe3++Fe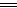 3Fe2+,则Fe2+为
3Fe2+,则Fe2+为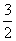 y,
y,
由题意:(x-y)= 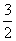 y,得
y,得 。
。
本题难度:简单