1、填空题 二硫化亚铁是Li/FeS2电池的正极活性物质,可用水热法合成。FeSO4、Na2S2O3、S及H2O在200℃连续反应24小时,四种物质以等物质的量反应,再依次用CS2、H2O洗涤、干燥及晶化后得到。
(1)合成FeS2离子方程式为?。
(2)用水洗涤时,如何证明S042-己除尽 ?。
(3)己知1.20gFeS2在O2中完全燃烧生成Fe2O3和SO2气体放出8.52kJ热量,FeS2燃烧反应的热化学方程式为 ?。
(4)取上述制得的正极材料1.1200g (假定只含FeS一种杂质),在足量的氧气流中充分加热,最后得0.8000g红棕色固体,则该正极材料中FeS2的质量分数(写出计算过程)。
?。
参考答案:
(1)Fe2+ + S2O32-+S+H2O 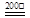 ?FeS2↓+2H+ + SO42-
?FeS2↓+2H+ + SO42-
(2)取少许最后一次洗涤滤液,先用足量盐酸酸化,再向上述清液中滴加BaCl2溶液,若不出现白色浑浊,表示已洗涤干净
(3)4FeS2(s) +11O2(g) = 2Fe2O3(s) + 8SO2(g) △H=-3408kJ·mol-1
[或FeS2(s) +11/4O2(g) = 1/2Fe2O3(s) + 2SO2(g) △H=-852kJ·mol-1]
(4)解:120n(FeS2)+88n(FeS) =1.1200
n(FeS2)+ n(FeS) =2×0.8000g/160g·mol-1
n(FeS2)=0.0075mol
ω(FeS2)= 0.0075mol×120g·mol-1/1.1200g≈0.8036
本题解析:(1)由题中信息可写出四种反应物,再由元素守恒和电荷守恒写出产物,Na2S2O3中一个S显+6价,一个S显-2价,其中-2的S与单质S发生归中反应,根据得失电子守恒配出反应。(2)检验SO42-,需要先用HCl去除干扰离子,以防生成除BaSO4以外的钡盐沉淀。(3)0.01mol FeS2完全燃烧放出8.52KJ的热量。写热化学方程式要标注物质的状态,同时?H应与化学计量系数成比例。(4)由质量关系,列出120n(FeS2)+88n(FeS) =1.1200,由铁守恒列出n(FeS2)+ n(FeS) =2×0.8000g/160,联合解得FeS2的量,进而求出含量。
本题难度:一般
2、选择题 将过氧化钠投入到氯化亚铁溶液中,可观察到的现象是(?)
A.最终生成白色沉淀
B.最终生成红褐色沉淀
C.最终出现灰绿色沉淀
D.无变化
参考答案:B
本题解析:过氧化钠具有强氧化性可以将亚铁氧化为三价铁,投入氯化亚铁溶液中时与水先反应生成氢氧化钠,再生成氢氧化铁沉淀,红褐色的沉淀,所以答案选B。
本题难度:简单
3、选择题 向只含有Fe3+、Cu2+、H+各0.1mol及a mol SO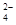 的某溶液中(只来源于水电离的离子不考虑)加入足量锌粉,搅拌使其充分反应,下列说法中正确的是(?)
的某溶液中(只来源于水电离的离子不考虑)加入足量锌粉,搅拌使其充分反应,下列说法中正确的是(?)
A.当消耗13克Zn时, 得到的还原产物为0.25mol
B.当溶液中不再产生气泡时,溶液中大量存在的阳离子只有Zn2+
C.反应中最多有两种单质生成
D.反应结束时,可得到0.25molZnSO4
参考答案:A
本题解析:三种阳离子的氧化性大小顺序是Fe3+、Cu2+、H+,所以首先还原的是Fe3+、然后是Cu2+,最后是H+。13g锌是0.2mol,失去0.4mol电子,所以根据电子的得失守恒可知,还原产物应该是0.1mol亚铁离子、0.1mo铜和0.05mol氢气,所以A正确,B不正确,含有亚铁离子;C不正确,锌足量还能生成单质铁,D不正确,应该是0.30mol硫酸锌,答案选A。
本题难度:一般
4、选择题 用以下三种途径来制取相同质量的硝酸铜:①铜与浓硝酸反应;②铜与稀硝酸反应;③铜与氧气反应生成CuO,CuO再与稀硝酸反应。下列有关叙述不正确的是?( )
A.所消耗的硝酸的量:①>②>③
B.对环境造成的危害,③最小
C.因铜与浓硝酸作用最快,故制取硝酸铜的最佳方案是①
D.三种途径所消耗的铜的质量相等
参考答案:C
本题解析:略
本题难度:一般
5、选择题 Fe和Fe2O3的混合物共13.6g,加入150mL稀H2SO4,在标准状况下收集到1.12LH2,Fe和Fe2O3均无剩余。为中和过量的H2SO4,并使FeSO4全部转化为Fe(OH)2沉淀,消耗了200mL 3mol/L的NaOH溶液,则该H2SO4的物质的量浓度为
A.2.25mol/L
B.2mol/L
C.0.3mol/L
D.0.6mol/L
参考答案:B
本题解析:分析题意:该过程中遵循元素守恒规律,溶液中的硫酸根离子的物质的量不变,最后的溶液是硫酸钠溶液,钠元素来自氢氧化钠,所以n(Na+)=2n(SO42-)=0.2L×3mol/L=0.6mol,所以n(SO42-)=0.3mol,c(H2SO4)=0.3mol/0.15L=2mol/L,答案选B。
本题难度:一般