1、计算题 (10分)将54.4 g铁粉和氧化铁的混合物中加入200 mL的稀硫酸,恰好完全反应,放出氢气4.48 L(标准状况).反应后的溶液中滴加KSCN不显红色,且无固体剩余物,求:⑴.混合物铁和氧化铁各是多少克?⑵.原稀硫酸物质的量浓度?⑶.反应后得到FeSO4的物质的量是多少?
参考答案:
⑴.设铁粉的物质的量为x,氧化铁的物质的量为y。
据:Fe+H2SO4=FeSO4+H2↑和Fe+2Fe3+=3Fe2+可以得到:
x-y=0.2 mol
56x+160y=54.4 g?解得:x=0.4mol,y=0.2mol 。
所以铁的质量为22.4g,氧化铁的质量为32g。
⑵.反应中共生成FeSO4 0.8mol,所以消耗H2SO4的物质的量为0.8mol,稀硫酸的浓度为0.8mol/0.2L=4.0mol/L。
⑶.根据铁元素的物质的量守恒,反应后FeSO4的物质的量为0.8mol。
本题解析:
由题意可知:(1)Fe2O3+6H+=2Fe3++3H2O、(2)Fe+2Fe3+=3Fe2+、(3)Fe+H2SO4=FeSO4+H2↑,要满足题意,铁粉一部分和三价铁离子反应,一部分和硫酸反应;所以设铁粉的物质的量为x,质量为56x,氧化铁的物质的量为y,其质量为160y,得到第一个方程程式:56x+160y=54.4g,由方程式(2)可知,与硫酸反应的铁粉的物质的量为x-y,同时由生成的H2标况下的体为22.4L可知,x-y="22.4L/22.4L·mol=0.2mol;" 两个方程式联立即可求得x=0.4mol,y=0.2mol ;所以铁的质量为22.4g,氧化铁的质量为32g。
(2)由题意和方程式(2)(3)可知,溶液最终为FeSO4,所以亚铁离子的物质的量等于硫酸根离子的物质的量;反应中共生成FeSO4 0.8mol,所以消耗H2SO4的物质的量为0.8mol,稀硫酸的浓度为0.8mol/0.2L=4.0mol/L。
⑶.根据铁元素的物质的量守恒,反应后FeSO4的物质的量为0.8mol。
本题难度:困难
2、选择题 下列有关铁及其化合物的说法中不正确的是( )
A.分别还原a mol Fe2O3所需H2、Al、CO物质的量之比为3 ∶2 ∶3
B.铁在纯氧中燃烧或高温下和水蒸气反应均能得到Fe3O4
C.工业上可用铁制容器储存、运输浓硝酸、浓硫酸
D.检验某物质是否含Fe2O3的操作步骤为:样品→粉碎→加热→溶解→过滤→向滤液中加KSCN溶液
参考答案:D
本题解析:样品在粉碎、加热、溶解、过滤的过程中其中可能含有的Fe2+已被氧化,故D不正确。
本题难度:一般
3、选择题 某溶液中,Fe3+、Cu2+、Fe2+的物质的量浓度之比为4:2:1,加入适量的铁粉,充分反应后,溶液中Fe3+、Cu2+、Fe2+的物质的量浓度之比变为1:1:2;则投入的铁粉与原溶液中Cu2+的物质的量之比为
A.1:1
B.1:2
C.2:1
D.2:3
参考答案:B
本题解析:假设原溶液中e3+、Cu2+、Fe2+的物质的量分别是(mol)4、2、1,设投入的铁是x。则根据方程式2Fe3++Fe=3Fe2+可知消耗铁离子是2x,生成亚铁离子是3x,所以(4mol-2x)︰2︰(1mol+3x)=1:1:2,解得x=1,所以投入的铁粉与原溶液中Cu2+的物质的量之比为1:2,答案选B。
本题难度:一般
4、计算题 (6分)将足量铁投入到200mLH2SO4和CuSO4的混和溶液中,充分反应后,产生H21.12L(标准状况),铁块的质量减轻了1.2g。求原溶液中c(H2SO4)及c(CuSO4)。(假设反应前后溶液的体积不变)
参考答案:
Fe?+? H2SO4?=? FeSO4?+? H2↑
56g? 1mol? 22.4L
m1(Fe)? n(H2SO4)? 1.12L
m1(Fe)=
n(H2SO4)=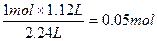
V(液)=V(H2SO4)=V(CuSO4)=200mL=0.2L
C(H2SO4)=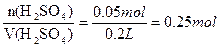
Fe?+? CuSO4? ?=? FeSO4?+? Cu
?=? FeSO4?+? Cu
56g? 1mol? 64g
m2(Fe)? n(CuSO4)? m(Cu)
m(Cu)=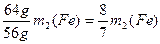
由题意得:m1(Fe) +m2(Fe)-m(Cu)=1.2g
2.8g+m2(Fe)-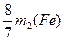 =1.2g
=1.2g
m2(Fe)=11.2g
n(CuSO4)=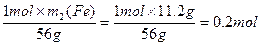
c(CuSO4)=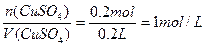
本题解析:略
本题难度:一般
5、选择题 下列化合物不是黑色的是
A.FeO
B.FeS
C.Fe3O4
D.Fe2O3
参考答案:D
本题解析:氧化铁是红色的,其他都是黑色的,所以选D。
本题难度:简单