|
高中化学知识点讲解《离子方程式的书写及正误判断》高频试题强化练习(2019年最新版)(六)
2019-06-25 22:36:10
【 大 中 小】
|
1、选择题 下列离子方程式与所述事实相符且正确的是
A.漂白粉溶液在空气中失效:ClO-+CO2+H2O=HClO+HCO3-
B.Ca(HCO3)2溶液中加入足量NaOH溶液:HCO3-+OH-=H2O+CO32-
C.向NaAlO2溶液中通入过量CO2制Al(OH)3 :AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
D.氢氧化钙溶液与碳酸氢镁溶液反应:HCO3—+Ca2++OH—=CaCO3↓+H2O
|
参考答案:C
本题解析:A、次氯酸钙吸收空气中的CO2生成次氯酸而变质,即漂白粉溶液在空气中失效可表示为Ca2++2ClO-+CO2+H2O=2HClO+CaCO3↓,A错误;B、Ca(HCO3)2溶液中加入足量NaOH溶液生成碳酸钙、碳酸钠和水,离子方程式为Ca2++2HCO3-+2OH-=2H2O+CO32-+CaCO3↓,B错误;C、向NaAlO2溶液中通入过量CO2生成Al(OH)3沉淀和碳酸氢钠,离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,C正确;D、氢氧化钙溶液与碳酸氢镁溶液反应生成碳酸钙沉淀、氢氧化镁沉淀和水,离子方程式为2HCO3—+2Ca2++4OH—+Mg2+=2CaCO3↓+2H2O+Mg(OH)2↓,D错误,答案选C。
考点:考查离子方程式的正误判断
本题难度:一般
2、填空题 (10分)写出下列反应的离子方程式:
(1)钠投入到水中反应的离子方程式为:__ ____
(2)服用胃舒平[主要成分是Al(OH)3]治疗胃溃疡,反应的离子方程式为:
(3)铁片插入硫酸铜溶液中: __________________________________。
(4)CH3COOH与NaOH溶液的中和反应:
(5)Ba(OH)2与CuSO4溶液反应:
参考答案:(10分)
(1)2Na+2H2O ===2Na++2OH-+H2↑
(2)Al(OH)3+3H+===Al3++3H2O
(3)Fe+Cu2+= Fe 2++ Cu
(4)CH3COOH+OH-===CH3COO-+H2O
(5)Ba2++2OH-+Cu2++SO42-===BaSO4↓+Cu(OH)2↓
本题解析:(1)钠与水反应生成强碱氢氧化钠和氢气,所以离子方程式是2Na+2H2O ===2Na++2OH-+H2↑;
(2)胃里主要含有盐酸,盐酸是强酸,所以氢氧化铝与盐酸反应生成氯化铝和水,氢氧化铝是难溶于水的化合物,所以离子方程式是Al(OH)3+3H+===Al3++3H2O;
(3)铁与硫酸铜溶液腐蚀置换反应生成Cu和硫酸亚铁,硫酸亚铁是易溶盐,所以离子方程式是Fe+Cu2+= Fe 2++ Cu;
(4)醋酸是弱酸,与氢氧化钠溶液反应生成醋酸钠和水,所以离子方程式中,醋酸不能拆开,离子方程式是CH3COOH+OH-===CH3COO-+H2O;
(5)Ba(OH)2与CuSO4溶液反应生成硫酸钡沉淀和氢氧化铜沉淀,沉淀都不能拆开,所以离子方程式是Ba2++2OH-+Cu2++SO42-===BaSO4↓+Cu(OH)2↓。
考点:考查离子方程式的书写
本题难度:一般
3、填空题 (12分).铅及其化合物可用于蓄电池、耐酸设备及X射线防护材料等。回答下列问题:
(1)铅是碳的同族元素,比碳多4个电子层,铅在元素周期表的位置为 ,
PbO2的酸性比CO2的酸性 (填“强”或“弱”)。
(2)PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为 。
(3)PbO2可由PbO与次氯酸钠溶液反应制得反应的离子方程式为 ;
PbO2也可以通过石墨为电极Pb(NO3)2和Cu(NO3)2的混合溶液为电解液电解制取。阳极发生的电极反应式为_ _。若电解液中不加入Cu(NO3)2,主要缺点是 。
(4)PbO2在加热过程发生分解的失重曲线如下图所示,已知失重曲线上的a点为样品失重4.0%(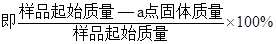 )的残留固体,若a点固体组成表示为PbOX或mPbO2·nPbO,列式计算x值和m:n值_ 。 )的残留固体,若a点固体组成表示为PbOX或mPbO2·nPbO,列式计算x值和m:n值_ 。
参考答案:(12分)(第1小题每空1分,其余每空2分)
(1) 第六周期第ⅣA族 弱
(2)PbO2+4HCl(浓)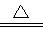 PbCl2+Cl2↑+2H2O PbCl2+Cl2↑+2H2O
(3)PbO+ClO—= PbO2+Cl- Pb2++2H2O - 2e-= PbO2↓+ 4H+
不能有效利用Pb2+
(4)根据PbO2 PbO PbO + +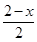 O2↑,有 O2↑,有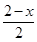 ×32= ×32=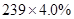 , ,
 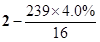 ="1.4" ,根据mPbO2·nPbO, ="1.4" ,根据mPbO2·nPbO, , ,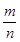 = = = =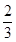
本题解析:(1)Pb在元素周期表中位于第六周期第ⅣA族,根据元素周期律可知,同主族元素从上到下,元素的非金属性逐渐减弱,所以PbO2的酸性比CO2的酸性弱;
(2)PbO2与浓盐酸共热生成黄绿色气体,该黄绿色气体是氯气,说明Cl元素被氧化,则Pb元素被还原为Pb2+,反应的化学方程式为PbO2+4HCl(浓) PbCl2+Cl2↑+2H2O; PbCl2+Cl2↑+2H2O;
(3)PbO与次氯酸钠溶液反应制得PbO2,Pb元素被氧化,则Cl元素被还原为氯离子,离子方程式为PbO+ClO—= PbO2+Cl-;石墨为电极Pb(NO3)2和Cu(NO3)2的混合溶液为电解液电解制取PbO2,阳极发生氧化反应,则Pb2+失去2个电子生成+4价的PbO2,根据元素守恒,发生反应的离子方程式为:Pb2++2H2O - 2e-= PbO2↓+ 4H+,若电解液中不加入Cu(NO3)2,阴极上Pb2+获得电子生成Pb,阴极电极反应式为:Pb2++2e-=Pb↓,Pb2+的利用率降低;
(4)若a点固体组成表示为PbOx,根据PbO2 PbO PbO + +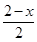 O2↑,设开始有1mol PbO2固体,质量是239g,则a点有 O2↑,设开始有1mol PbO2固体,质量是239g,则a点有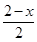 ×32= ×32=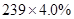 ,解得x=1.4,则mPbO2·nPbO中O原子的个数平均是1.4,所以(2m+n)/(m+n)=1.4,m:n=2:3. ,解得x=1.4,则mPbO2·nPbO中O原子的个数平均是1.4,所以(2m+n)/(m+n)=1.4,m:n=2:3.
考点:考查元素周期表与元素周期律、常用化学用语、电解原理、方程式的计算
本题难度:困难
4、选择题 下列反应的离子方程式正确的是
A.氨气通入醋酸溶液 CH3COOH+NH3 ="=" CH3COONH4
B.澄清的石灰水跟盐酸反应 HCl+OH-="=" H2O+Cl-
C.碳酸钙溶于醋酸 CaCO3+2H+ ="=" Ca2++H2O+CO2↑
D.金属钠跟水反应 2Na+2H2O ="=" 2Na++2OH-+H2↑
|