1、填空题 (11分)某合金由A、B、C、D 四种元素组成,这四种元素位于周期表中前四周期,A是主要成分元素,A的基态原子中有4个未成对电子。B是第一主要的合金元素,B的含量不低于11%,否则不能生成致密氧化膜BO3防止腐蚀,B与A同周期,且原子核外未成对电子数最多。C位于周期表中第4行、第10列,D的基态原子的最外层电子数是其电子层数的2倍,未成对电子数与电子层数相等。
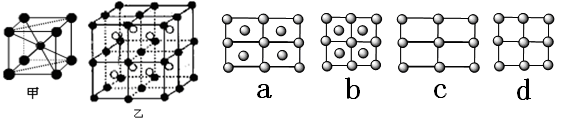
(1)A的原子结构示意图是?。A的一种晶体的晶胞如图甲,乙图中●和○表示的是同种原子,即乙是8个甲无隙并置的结果,若按甲图中虚线方向切乙,得到a~d图中正确的是?。
(2)写出B原子的基态的外围电子排布式_________________,与B同周期且基态原子最外层电子数与B相同的元素,可能位于周期表中的___区和 ___区。
(3)基态D原子的外围电子排布图是 。据报道,只含镁、C和D三种元素的晶体竟然具有超导性。该晶体的结构(如图示)可看作由镁原子和C原子在一起进行面心立方密堆积,该晶体的化学式为?。晶体中每个 原子周围距离最近的
原子周围距离最近的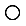 原子有?个。
原子有?个。
图中:●表示D原子, 表示C原子,
表示C原子, 表示镁原子
表示镁原子
(4)(已知 =1.414)CXO晶体晶胞结构为NaCl型,由于晶体缺陷,x值为0.88,晶胞边长为4.28×10-10m。晶胞中两个C原子之间的最短距离为___________m(精确至0.01)。若晶体中的C分别为C2﹢、C3﹢,此晶体中C2﹢与C3﹢的最简整数比为_________。
=1.414)CXO晶体晶胞结构为NaCl型,由于晶体缺陷,x值为0.88,晶胞边长为4.28×10-10m。晶胞中两个C原子之间的最短距离为___________m(精确至0.01)。若晶体中的C分别为C2﹢、C3﹢,此晶体中C2﹢与C3﹢的最简整数比为_________。
参考答案:、(1)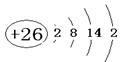 ?a? (2)? 3d54s1? s和ds区?
?a? (2)? 3d54s1? s和ds区?
(3) ? MgCNi3?12
? MgCNi3?12
(4)3.03×10-10m(2分)? 8:3(2分)
本题解析:根据元素的结构和性质可知,A、B、C、D 四种元素分别是Fe、Cr、Ni、C。
(1)铁的原子序数为26,所以Fe的原子结构示意图为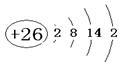 。根据甲和乙的结构可知,选项a正确,答案选a。
。根据甲和乙的结构可知,选项a正确,答案选a。
(2)根据构造原理可知,Cr原子的基态的外围电子排布式3d54s1。B同周期且基态原子最外层电子数与B相同的元素是K或铜,分别位于s区和ds区。
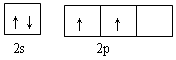
(3)根据构造原理可知,碳原子的外围电子排布图是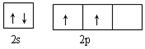 。根据晶胞结构可知镁原子个数是8×1/8=1,Ni原子个数是6×1/2=3,碳原子在中心,全部属于该晶胞,属于化学式为MgCNi3 。晶体中每个镁原子周围距离最近的Ni原子有3×8÷2=12。
。根据晶胞结构可知镁原子个数是8×1/8=1,Ni原子个数是6×1/2=3,碳原子在中心,全部属于该晶胞,属于化学式为MgCNi3 。晶体中每个镁原子周围距离最近的Ni原子有3×8÷2=12。
(4)根据氯化钠的晶胞可知,晶胞中两个Ni原子之间的最短距离为 ×(4.28×10-10m÷2)=3.03×10-10m。设晶体中C2﹢与C3﹢的个数分别是a和b,则2a+3b=2,a+b=0.88,解得a=0.64,b=0.24,所以晶体中C2﹢与C3﹢的最简整数比为8:3。
×(4.28×10-10m÷2)=3.03×10-10m。设晶体中C2﹢与C3﹢的个数分别是a和b,则2a+3b=2,a+b=0.88,解得a=0.64,b=0.24,所以晶体中C2﹢与C3﹢的最简整数比为8:3。
本题难度:一般
2、选择题 下列说法中不正确的是
A.在金刚石晶体最小的碳原子环上有6个碳原子
B.在氯化铯晶体中每一个Cs+周围与其等距离且最近的Cl-有8个
C.在氯化钠晶体中每一个Na+周围与其等距离且最近的Na+有12个
D.水是一种非常稳定的化合物,这是由于水分子间能形成氢键的缘故
参考答案:B
本题解析:在氯化铯晶体中每一个Cs+周围与其等距离且最近的Cl-有3×8/2=12个,即选项B不正确,其余都是正确的,答案选B。
本题难度:一般
3、计算题 如果1 mol金属钠的质量为23 g,密度ρ=0.97 g·cm-3,则每个钠原子的半径约为多少?(设钠为紧密堆积的球体)
参考答案:2.11×10-8 cm
本题解析:由于钠为紧密堆积的球体,则体积V与密度的关系为V=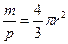 ,
,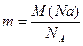 。钠原子半径
。钠原子半径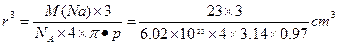 =9.4×10-24 cm3,r=
=9.4×10-24 cm3,r=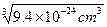 =2.11×10-8 cm。
=2.11×10-8 cm。
本题难度:简单
4、选择题 下列化学式能真实表示物质分子组成的是?(?)?
①NaOH?②SiO2?③SO3?④He?⑤P ⑥Na2O2
A.②③⑤
B.③⑤
C.③④
D.③④⑤
参考答案:C
本题解析:在离子晶体和原子晶体中不存在分子,所以其化学式不能代表物质的分子组成。只有在分子晶体中才存在分子,其化学式代表物质的分子组成。因为磷有多种同素异形体,所以⑤也不能代表物质的分子组成。答案是C。
本题难度:简单
5、选择题 X、Y两元素的质子数之和为22,X的原子核外电子数比Y少6个,下列说法中不正确的是(?)
A.Y的单质固态时是原子晶体
B.X的单质固态时为分子晶体
C.X与碳形成的化合物固态时为分子晶体
D.X与Y形成的化合物固态时为分子晶体
参考答案:D
本题解析:根据X、Y两元素的质子数之和为22,X的原子核外电子数比Y少6个可知X是氧元素,Y是硅元素。二氧化硅是原子晶体,D不正确。其余都是正确的,所以答案选D。
本题难度:简单