|
高考化学知识点归纳《离子共存》试题预测(2019年最新版)(四)
2019-06-25 22:39:38
【 大 中 小】
|
1、选择题 甲、乙两种溶液中分别含有大量的Cu2+、K+、H+、Cl-、CO32-、OH-这6种离子中的3种(两种溶液中的离子不重复),已知甲溶液呈蓝色,则乙溶液中大量存在的离子是
A.K+、OH-、CO32-
B.Cu2+、H+、Cl-
C.K+、H+、Cl-
D.CO32-、OH-、Cl-
|
参考答案:A
本题解析:甲呈蓝色说明甲中含有Cu2+,氢氧化铜,碳酸铜是沉淀,所以乙中有OH-、CO32-,由于氢离子和OH-反应不能大量共存,又由于溶液呈电中性,则乙中有K+,所以选A。
考点:考查离子之间的反应及离子共存等知识。
本题难度:一般
2、选择题 下列液体均处于25℃,有关叙述正确的是
A.某物质的溶液pH<7,则该物质一定是酸或强酸弱碱盐
B.pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的102倍
C.常温时,某溶液中由水电离出来的c(H+)和c(OH-)的乘积为1×10-24,该溶液中一定可以大量存在K+、Na+、AlO2-、SO42-
D.常温时,0.l mol/L HA溶液的pH>l,0.1 mol/L BOH溶液中c(OH-)/c(H+)=l012,将这两种溶液等体积混合,混合后溶液中离子浓度的大小关系为:c(B+)>c(OH-)>c(H+)>c(A-)
参考答案:B
本题解析:某物质的溶液pH<7,则该物质除了是酸或强酸弱碱盐,还有可能是酸式盐,A选项错误;pH=4.5的番茄汁中c(H+)=10-4.5,pH=6.5的牛奶中c(H+)=10-6.5,10-4.5:10-6.5=100,B选项正确;常温时,某溶液中由水电离出来的c(H+)和c(OH-)的乘积为1×10-24,则c(H+)=c(OH-)=1×10-12,即可能是酸性溶液,也可能是碱性溶液,AlO2-存在碱性溶液不能存在酸性溶液,所以应该说该溶液中可能大量存在K+、Na+、AlO2-、SO42-,不能说一定,C选项错误;0.1mol·L-1 HA溶液的pH>1,说明HA是弱酸,0.1mol·L-1 BOH溶液中c(OH-)/c(H+)=1012,可以利用水的离子积常数计算出c(OH-)=0.1mol·L-1,所以碱是强碱,反应后溶液生成的盐AB水解显碱性,由于水解程度一般都比较小,所以离子浓度的大小顺序为c(B+)>c(A-)>c(OH-)>c(H+),D选项错误。
本题难度:一般
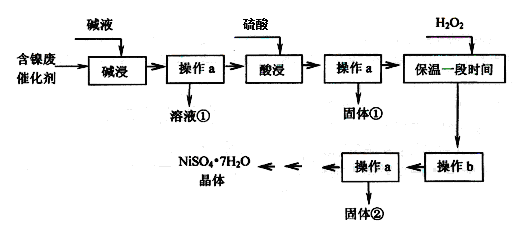
3、填空题 某化工厂的含镍废催化剂主要含Ni,还含有Al、Al2O3、Fe、FeO、Fe2O3及其他不溶杂质(其他不溶杂质不与酸碱反应)。某校化学研究性学习小组设计了如下图所示的方法,以该含镍废催化剂为原料来制备NiSO4·7H2O。
【查阅资料】
①Ni能与非氧化性酸反应生成Ni2+,不与碱液反应。
②部分阳离子以氢氧化物形式沉淀时pH如下:
沉淀物
| Al(OH)3
| Fe(OH)3
| Fe(OH)2
| Ni(OH)2
| 开始沉淀的pH
| 4.1
| 1 .7
| 7.6
| 7.0
| 完全沉淀的pH
| 5.2
| 3.2
| 9.5
| 9.2
|
回答下列问题:
(1)操作a为?。
(2)“碱浸”的目的是除去?(填化学式)。
(3)操作b为调节溶液的pH,你认为pH的最佳调控范围是??。
(4)NiSO4在强碱溶液中用次氯酸钠氧化,可以制得碱性镍氢电池电极材料NiOOH。
①写出该反应的离子方程式?。
②已知碱性镍氢电池总反应: H2+2NiOOH 2Ni(OH)2,写出该反应放电时正极反应式?。 2Ni(OH)2,写出该反应放电时正极反应式?。
(5)一般认为残留在溶液中的离子浓度小于1.0×10-5 mol·L-1时,沉淀已经完全。请利用上表中数据估算Fe(OH)2的溶度积 ?。 ?。
参考答案:(1)过滤 (2分)?(2)Al、Al2O3(2分)?(3)3.2≤pH<7.0 (2分)
(4)①2Ni2++ClO-+4OH-=2NiOOH+Cl-+H2O(3分)?②NiOOH + H2O + e- = Ni(OH)2 + OH- (3分)
(5)1.0×10-14 mol3·L-3(2分)
本题解析:(1)捏Ni、Fe、FeO、Fe2O3及其他不溶杂质均不与碱反应,所以碱液浸后金属铝、氧化铝溶解,其它物质不溶,过滤即可除去,所以操作a是过滤。
(2)“碱浸”的目的是除去含镍废催化剂Al、Al2O3。
(3)由于前面加入了氧化剂双氧水,所以溶液中的亚铁离子被氧化生成了铁离子。根据表中数据可知,铁离子完全沉淀时的pH值是3.2,而Ni2+开始沉淀时的pH值是7.0,因此操作b应该控制溶液的pH值为3.2≤pH<7.0。
(4)①NiSO4在强碱溶液中用次氯酸钠氧化,可以制得碱性镍氢电池电极材料NiOOH,在反应中氯元素的化合价从+1价降低到-1价,得到2个电子。而Ni元素的化合价从+2价升高到+3价失去1个电子,所以还原剂硫酸镍与氧化剂次氯酸钠的物质的量之比是2:1,因此反应的离子方程式为2Ni2++ClO-+4OH-=2NiOOH+Cl-+H2O。
②原电池中负极失去电子,发生氧化反应。电子经导线传递到正极,所以正极得到电子,发生还原反应。根据方程式可知放电时氢气是还原剂失去电子,NiOOH是氧化剂得到电子,做正极,因此正极电极反应式为NiOOH + H2O + e- = Ni(OH)2 + OH-。
③根据表中数据可知,氢氧化亚铁完全沉淀时的pH值是9.5,根据氢氧化亚铁的溶度积常数表达式Ksp=c(Fe2+)·c2(OH-),氢氧化亚铁的溶度积常数Ksp=1.0×10-5 mol·L-1×(10-4.5mol/L)2=1.0×10-14 mol3·L-3。
本题难度:一般
4、选择题 在下列溶液中,各组离子一定能够大量共存的是( )
A.1.0?mol?L-1?的复盐NH4Fe(SO4)2溶液中:Na+、S2-、Cl-、OH-
B.常温下,c(H+)/c(OH-)=10-12的溶液中:Na+、SO42-、NO3-、Fe2+
C.pH=1的溶液中:Al3+、NH4+、Br-、Cl-
D.与铝反应产生大量氢气的溶液:Na+、K+、HCO3-、NO3-
参考答案:A.因Fe3+、OH-结合生成沉淀,Fe3+、S2-发生氧化还原反应,则不能共存,故A错误;
B.常温下,c(H+)/c(OH-)=10-12的溶液,c(H+)=0.1mol/L,NO3-、Fe2+发生氧化还原反应,则不能共存,故B错误;
C.pH=1的溶液中有大量的H+,该组离子之间不反应,则能共存,故C正确;
D.与铝反应产生大量氢气的溶液,为酸或碱溶液,HCO3-既能与酸反应又能碱反应,则不能共存,故D错误;
故选C.
本题解析:
本题难度:一般
5、选择题 某无色透明溶液中,放入铝片,立刻有大量H2生成,则下列离子在该溶液中可能大量存在的是( )
A.OH- NO3- Ba2+ Cl-
B.H+ Ba2+ Mg2+ NO3-
C.H+ Cu2+ Al3+ SO42-
D.Na+ K+ MnO4- Cl-
参考答案:A.溶液无色,在碱性条件下能生成氢气,且离子之间不发生任何反应,能大量共存,故A正确;
B.溶液无色,碱性条件下Mg2+不能存在,在酸性条件下,由于NO3-具有强氧化性,不生成氢气,故B错误;
C.Cu2+有颜色,不符合题目无色的要求,故C错误;
D.MnO4-有颜色,不符合题目无色的要求,故D错误.
故选A.
本题解析:
本题难度:简单
|  2Ni(OH)2,写出该反应放电时正极反应式?。
2Ni(OH)2,写出该反应放电时正极反应式?。 ?。
?。