1、推断题 下图表示A-E五种物质的相互转化关系,其中A为淡黄色粉末,C为单质,D为离子化合物。
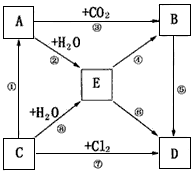
(1)推断A为___ _______;B为___________;C为__________;D为___________(填化学式)
(2)写出②、③的化学方程式:
②______________________________;
③______________________________。
(3)请写出过量的E和Ca(HCO3)2溶液反应的离子方程式:_________________________。
(4)将C投入足量的FeCl3的水溶液中,写出发生的总反应的离子方程式。________________________。
参考答案:(1)Na2O2;Na2CO3;Na;NaCl
(2)2Na2O2+2H2O==4NaOH+O2↑;2Na2O2+2CO2==2Na2CO3+O2
(3)2OH-+Ca2++2HCO3-==CaCO3↓+CO32-+2H2O
(4)6Na+6H2O+2Fe3+==6Na++2Fe(OH)3↓+3H2↑
本题解析:
本题难度:困难
2、简答题 已知A、B、C、D分别是中学化学中常见的四种不同粒子,它们之间有如下图所示反应关系.
(1)如果A、B、C、D均是10电子粒子,
①请写出A的化学式______
②A和B反应生成C、D的离子反应方程式______
(2)如果A、C均是18电子的粒子,B、D?均是10电子粒子,请写出C的电子式______.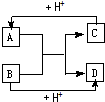
参考答案:(1)如果A、B、C、D均是10电子粒子,结合10电子微粒的结构性质特征判断为:A为NH4+,B为OH-,C为NH3,D为H2O;反应为:NH4++OH-=NH3+H2O;或为:HF+OH-═F-+H2O
①A的化学式为:NH4+?(或HF)
②A和B反应生成C、D的离子反应方程式为:NH4++OH-═NH3↑+H2O?(或HF+OH-═F-+H2O?)
故答案为:NH4+ (或HF);NH4++OH-═NH3↑+H2O (或HF+OH-═F-+H2O )
(2)如果A、C均是18电子的粒子,B、D 均是10电子粒子,结合微粒的性质特征推断:A为H2S,B为OH-,C为HS-或S2-,D为H2O;所以C的电子式为:
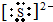
或者
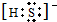
;
故答案为:
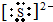
或者
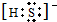
本题解析:
本题难度:一般
3、填空题 (8分)A、B、C、D、E、F六种物质的相互转化关系如右图所示。图中反应条件均未标出,部分产物(包括水)已略去,反应①是置换反应。
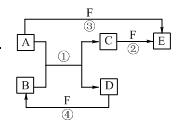
(1)若B、C、F都是气态单质,且B为黄绿色有毒气体。③和④两个反应中都有水生成,反应②需要放电才能发生。A、D均为极易溶于水的气态氢化物,且相遇有白烟生成。则A分子的立体构型为?,反应③的化学方程式为 ?。
?。
(2)若A、D为短周期元素的单质,且所含元素的原子序数A是D的2倍,所含元素的原子最外层电子数D是A的2倍。F是一种含氧酸,③和④两个反应中都有红棕色气体生成。则E的化学式为
? ?
? ?,反应④的化学方程式为?。
?,反应④的化学方程式为?。
参考答案:(1)三角锥形(2分);?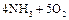

 (2分)
(2分)
(2)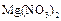 (2分);?
(2分);?

 ?(2分)
?(2分)
本题解析:略
本题难度:一般
4、填空题 已知反应?①、②是化工生产中的两个重要反应:
①甲溶液
?A+B+C
②乙经过粉碎后在沸腾炉中燃烧,得到D和E
其中,A、D在常温常压下为刺激性气味气体,C为无色无味气体.请回答:
(1)A的电子式是______.
(2)将A通入B的溶液中,反应的离子方程式是______.
(3)1g?C在A中燃烧时放出92.3kJ的热量,该反应的热化学方程式是
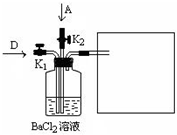
______.
(4)工业上可利用E为原料冶炼其中所含的金属,方法是______.
(5)将A和D按物质的量1:1通入如图装置中:
该过程中的化学方程式是______.
上述实验装置设计不完整,请将所缺部分在装置图的右边方框中画出.
(6)一定条件下,将12g乙放入过量的浓硝酸中,反应过程中转移1.5mol电子,该反应的离子方程式是______.
参考答案:①化工生产中的甲溶液电解
本题解析:
本题难度:一般
5、填空题 A是单质,D是A单质所含元素的最高价氧化物的水化物,甲、乙、丙、丁四种化合物间除甲与丁、丙与乙外,两两均能发生中和反应。已知有如下转化关系(部分产物和反应条件已略去);
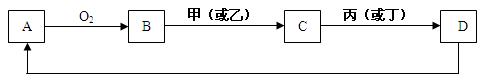
试回答:
(1) 写出B在工业生产中的一种用途?。
(2)写出B转化为C的可能的离子方程式?。
(3)若C的溶液显酸性,用离子方程式表示其净水的原理?。
(4)若C为钠盐,用含m mol C的溶液与1L n mol·L-1的盐酸充分反应,已知m/n=1/2,则生成D的物质的量为?mol。
(5)用A单质和铂作电极,与海水、空气组成海洋电池,写出铂电极上发生反应的电极反应式?;若负极材料消耗18g,则电池转移的电子总数为?。?(阿伏加德罗常数用NA表示)
参考答案:(1)工业上制备Al(或作耐火材料)?(1分)
(2)Al2O3+6H+=2Al3++3H2O? Al2O3+2OH—+3H2O = 2[Al(OH)4]— ?或
Al2O3+2OH—=AlO2–+H2O (各2分,共4分)
(3)Al3++3H2O  Al(OH)3(胶体)+3H+?(2分)
Al(OH)3(胶体)+3H+?(2分)
(4)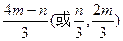 ?(3分)
?(3分)
(5)O2+2H2O+4e—=4OH—? 2NA?(各2分,共4分)
本题解析:略
本题难度:一般