1、选择题 已知X、Y、Z和R分别代表4种元素。如果aXm+、bYn+、cZn-、dRm-四种离子的电子层结构相同(a、b、c、d为元素的原子序数),则下列关系正确的是( )
A.a-c=m-n
B.a-b=n-m
C.c-d=m+n
D.b-d=n+m
参考答案:D
本题解析:由题意可知,四离子的核外电子数相同,即:a-m=b-n=c+n=d+m,进而可得出只有D项正确。
本题难度:一般
2、填空题 (9分)
下表为元素周期表的一部分,请参照①~⑩在表中的位置,用化学用语回答 下列问题:
下列问题:
①
| ?
| ?
|
?
| ?
| ?
| ?
| ②
| ③
| ④
| ⑤
| ?
|
⑥
| 来
| ⑦
| ?
| ?
| ⑧
| ⑨
| ?
|
?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ⑩
| ?
| ?
| ?
| ?
|
| | | | | | | | | | | | | | | | |
|
(1)元素③形成的单质的电子式为?;元素②形成的最高价氧化物的结构式为?。
(2)②、③、④、⑤元素形成的氢化物中,热稳定性最强 的是?
的是? ?(填化学式),沸点最高的是?(填化学式)。
?(填化学式),沸点最高的是?(填化学式)。
(3)⑧、⑨元素的最高价氧化物的水化物酸性强弱比较?>?(填化学式)。
(4)⑥、⑦两元素的最高价氧化物的水化物之间反应的离子方程式为?。
(5)元素⑩在周期表中的位置?;
参考答案:

本题解析:略
本题难度:一般
3、选择题 下列物质中碱性最弱的是
A.氢氧化钠
B.氢氧化镁
C.氢氧化铝
D.氢氧化钙
参考答案:
C
本题解析:
本题考查元素金属性强弱。在钠、镁、铝、钙四种元素中,铝元素的金属性最弱,则铝元素对应的最高价氧化物的水化物的碱性最弱,C选项正确。
本题难度:一般
4、填空题 (15分)X、Y、Z、W、Q 五种元素原子序数依次增大,X原子核外的L层电子数是K层的两倍,Z原子外围电子排布式为nsnnp2n,W原子核外的M层中只有两对成对电子,Q的核电荷数是Z与W的核电荷数之和。请回答下列问题:
(1)X、W的元素符号依次为?、?;
(2)写出Y2的电子式____________________;
(3)WZ2与XZ2分子的空间结构分别是?和?,相同条件下两者在水中的溶解度较大的是?(写分子式);
(4)Q在元素周期表?区(填s、p、d、ds、f),其外围电子排布式为?,在形成化合物时它的最高化合价为?。
参考答案:(15分)(1)C? S ?(各2分)(2)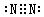 (2分)
(2分)
(3)V形?直线形? SO2?(各1分)
(4)d(2分)? 3d54s1?(2分)?+6(2分)
本题解析:根据元素的结构和性质可判断,X、Y、Z、W、Q 五种元素分别是C、N、O、S、Cr。
(2)氮气中含有3对电子对,所以电子式为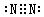 。
。
(3)SO2和CS2中中心原子含有对孤对电子分别是2对和0,所以前者是V形,后者是直线型。由于水水极性分子,所以根据相似相溶原理可知SO2在水中的溶解度大。
(4)区大名称来自于按构造原理最后填入电子的能级的符号,所以根据构造原理可知,铬元素是d区,其外围电子排布式为3d54s1?。外围电子共计6铬,所以最高价是+6价。
本题难度:一般
5、选择题 铊是超导材料的组成元素之一,铊在周期表中位于第六周期,与铝是同族元素,元素符号是Tl,以下对铊的性质的推断不正确的是
A.铊是易导电的银白色金属
B.能生成+3价离子化合物
C.T1(OH)3是两性氢氧化物
D.Tl的失电子能力比Al强
参考答案:C
本题解析:铊在周期表中位于第六周期,与铝是同族元素,元素符号是Tl,利用同主族元素的性质相似性和递变性规律来解答。A、铝为银白色金属,Tl与Al同主族,则铊是易导电的银白色金属,故A正确;B、第ⅢA族的最高价为+3,且为金属元素,则能生成+3价离子化合物,故B正确;C、同主族从上到下金属性增强,则Tl(OH)3是碱性氢氧化物,故C错误;D、同主族从上到下金属性增强,所以金属性Tl>Al,则Tl的失电子能力比Al强,故D正确;故选:C。
本题难度:一般