1、选择题 下列说法中,正确的是( )
A.CO2的摩尔质量是44 g
B.18 g H2O在标准状况下的体积是22.4 L
C.在标准状况下,20 mL NH3与60 mL O2所含的分子数比为1∶3。
D.将40 g NaOH溶于1 L水中,所得溶液的物质的量浓度为1 mol/L
参考答案:C
本题解析:A、CO2的摩尔质量是44 g/mol,g是质量的单位,错误;B、H2O在标况下为液体,错误;C、氨气和氧气的体积之比为20∶60=1∶3,由阿伏加德罗定律推断,二者的物质的量之比为1∶3,正确;D、溶液的体积应为1L,而非水的体积为1L,错误。
本题难度:一般
2、填空题 向FeCl2和FeCl3混合溶液中加入适量KOH,高速搅拌下加入油脂,过滤后干燥得到一类特殊的磁流体材料,其化学式通式为KxFeO2(其组成可理解为aK2O·bFeO·cFe2O3)。请回答下列问题:
(1)若x的平均值为1.3,则磁流体中Fe2+和Fe3+的质量之比为?。
(2)若x为1.4,请写出该磁流体在稀硫酸条件下与足量的KI溶液反应的化学方程式:?
将该反应设计为原电池,负极电极反应为?,当消耗1L 1.1mol/L KI溶液时,外电路通过电子数刚好为NA个,则该电池的化学能转化为电能的转化效率为?。
(3)为测定该磁流体中Fe2+的含量,取化学式为K1.5FeO2的样品2g溶解在稀硫酸中并稀释到100ml,取出2mL加入10ml 0.005mol/L的KMnO4(在酸性条件下KMnO4被Fe2+还原为Mn2+),充分反应后再加入150ml 0.001mol/L的FeSO4,溶液紫红色恰好完全褪色,则原样品中Fe2+的质量分数为?。溶解样品若选择稀硝酸测定结果?(填偏高,偏低,无影响)
参考答案:(1)3:7 ;
(2)10K1.4FeO2+6KI+20H2SO4=10FeSO4+3I2+ 10K2SO4+20H2O ;2I—-2e-= I2?;?90.9%;
(3)14%?偏低
本题解析:(1)当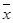 = 1.3时,即KxFeO2为K1.3FeO2,其最简整数比的化学式为K13Fe10O20即
= 1.3时,即KxFeO2为K1.3FeO2,其最简整数比的化学式为K13Fe10O20即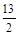 K2O·3FeO·
K2O·3FeO· Fe2O3,则n(Fe2+): n(Fe3+)=3:7,故m(Fe2+): m(Fe3+)=3:7。
Fe2O3,则n(Fe2+): n(Fe3+)=3:7,故m(Fe2+): m(Fe3+)=3:7。
(2)当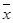 = 1.4时,即K1.4FeO2,当其在稀硫酸条件下与足量的KI溶液反应时,其反应实质是Fe3+和I-在酸性条件下发生氧化还原反应生成Fe2+和I2,K1.4FeO2的化学组成可看作7K2O·4FeO·3Fe2O3,故其化学反应方程式为:10K1.4FeO2+6KI+20H2SO4=10FeSO4+3I2+ 10K2SO4+20H2O;将该反应设计为原电池,则负极失电子发生氧化反应,故其电极反应式为:2I—-2e-= I2;由氧化还原反应可知,理论上每消耗1mol KI转移1mol电子即1NA个,而实际上消耗了1L 1.1mol/L KI溶液即消耗n(KI)= 1L×1.1mol/L=1.1mol,故该电池的化学能转化为电能的转化效率为1÷1.1×100%=90.9%。
= 1.4时,即K1.4FeO2,当其在稀硫酸条件下与足量的KI溶液反应时,其反应实质是Fe3+和I-在酸性条件下发生氧化还原反应生成Fe2+和I2,K1.4FeO2的化学组成可看作7K2O·4FeO·3Fe2O3,故其化学反应方程式为:10K1.4FeO2+6KI+20H2SO4=10FeSO4+3I2+ 10K2SO4+20H2O;将该反应设计为原电池,则负极失电子发生氧化反应,故其电极反应式为:2I—-2e-= I2;由氧化还原反应可知,理论上每消耗1mol KI转移1mol电子即1NA个,而实际上消耗了1L 1.1mol/L KI溶液即消耗n(KI)= 1L×1.1mol/L=1.1mol,故该电池的化学能转化为电能的转化效率为1÷1.1×100%=90.9%。
(3)根据氧化还原反应得失电子守恒知,KMnO4~5Fe2+(KMnO4→Mn2+得到5e-,Fe2+→Fe3+失去e-),依题意得与磁流体反应的n(KMnO4) = 10×10-3L×0.005mol/L-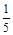 ×150×10-3L×0.001mol/L=0.02×10-3 mol,则取样(
×150×10-3L×0.001mol/L=0.02×10-3 mol,则取样(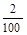 ×2g K1.5FeO2)中与KMnO4反应的n(Fe2+)=5×0.02×10-3 mol=0.1×10-3 mol,即m(Fe2+)=56g/mol×0.1×10-3 mol=5.6×10-3 g,故原样品中Fe2+的质量分数为5.6×10-3 g÷0.04g×100%=14%;若溶解样品时选择稀硝酸(具强氧化性)则会导致部分Fe2+被氧化成Fe3+,致使最终测得的Fe2+的质量分数偏低。
×2g K1.5FeO2)中与KMnO4反应的n(Fe2+)=5×0.02×10-3 mol=0.1×10-3 mol,即m(Fe2+)=56g/mol×0.1×10-3 mol=5.6×10-3 g,故原样品中Fe2+的质量分数为5.6×10-3 g÷0.04g×100%=14%;若溶解样品时选择稀硝酸(具强氧化性)则会导致部分Fe2+被氧化成Fe3+,致使最终测得的Fe2+的质量分数偏低。
本题难度:一般
3、选择题 无水KHCO3和K2CO3的混合物100 g,加热至质量不再变化时,产生 CO26.72 L(标准状况),则该混合物中 K2CO3的质量分数是(? )
A.13.4%
B.30%
C.40%
D.60%
参考答案:C
本题解析:K2CO3受热不分解,KHCO3分解如下:
2KHCO3 K2CO3+H2O↑+CO2↑
K2CO3+H2O↑+CO2↑
2×100? 22.4
x? 6.72
解x="60" g?所以K2CO3为40 g,占40%。
本题难度:简单
4、选择题 NA为阿伏加德罗常数,下列说法正确的是
A.标准状况下,11.2 L的己烷所含的分子数为0.5 NA
B.28 g乙烯所含共用电子对数目为4 NA
C.0.1molCnH2n+2中含有的C-C键数为0.1n NA
D.2.8 g乙烯和丙烯的混合气体中所含碳原子数为0.2 NA