1、实验题 I.某校化学学习小组为了探究草酸(H2C2O4)的化学性质,设计了如下实验:
小组成员在做草酸溶液与酸性高锰酸钾溶液反应实验时发现,溶液褪色先慢后快。
(1)上述H2C2O4溶液与酸性KMnO4溶液反应的离子方程为?。
(2)为了探究此反应速率由小变大的原因,甲同学做了如下实验(表中“一”表示未加入该试剂)。
实验
编号
| 反应温度
(利用水浴加热)
| 稀硫酸
溶液
| MnSO4固体
| 0.10 mol/L
KMnO4溶液
| 褪色
时间
|
1
| 750C
| 一
| 一
| 1mL
| 100s
|
2
| 750C
| 10滴
| 一
| 1mL
| 40s
|
3
| 750C
| 10滴
| 加入少许
| 1mL
| 3s
|
甲同学由此能够得出结论:??
II.乙同学查资料得知“菠菜中富含可溶性草酸盐和碳酸盐”, 决定用实验验证这一事实并检测草酸盐含量。进一步查阅资料得知,草酸(H2C2O4)是酸性强于醋酸的二元弱酸,对应的钙盐(CaC2O4)不溶于醋酸,能溶于强酸。
(1) 欲准确测定菠菜中草酸盐含量,回答有关问题:
①操作:取m g菠菜样品,将其中草酸盐转化为 CaC2O4 沉淀分离出来,用盐酸溶解后,溶液转入100mL容量瓶中加水配制成100mL溶液。每次移取25.00mL该溶液,用0.0100mol·L-1 KMnO4标准溶液滴定,滴定实验重复操作2 —3次。平均消耗标准溶液V mL。
②计算:菠菜中草酸盐(以C2O42-计)的质量分数为?。(只列式不计算,已知:C2O42-的的摩尔质量为88 g?mol-1)
③讨论:用标准KMnO4溶液直接滴定菠菜研磨、浸泡、过滤得到的溶液结果可能偏高,原因是??。
参考答案:I.(1)5H2C2O4+2MnO4?+6H+=2Mn2++10CO2↑+8H2O
(2)随着草酸溶液与高锰酸钾溶液反应的进行,生成了Mn2+,Mn2+作为该反应的催化剂,可以加快化学反应速率。
II.(1)②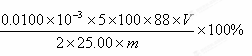
③菠菜中还含有其他还原性物质,能与KMnO4反应
本题解析:I.(1)高锰酸钾溶液具有氧化性,能氧化草酸为二氧化碳,依据原子守恒和电荷守恒配平书写离子方程式为:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O
(2)图表中高锰酸钾溶液加热,褪色时间较长,加入少许硫酸锰速率增大较快,反应需要的时间缩短,Mn2+起到催化作用,加入稀硫酸褪色时间缩短,说明生成的锰离子对分解起了催化作用。
II.(1)②依据反应的离子方程式计算,设草酸物质的量为x:
5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O
5? 2
x? 0.0100mol/L×v×10-3L
可得菠菜中草酸盐(以C2O42-计)的 质量分数为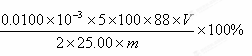
③用标准KMnO4溶液直接滴定菠菜研磨、浸泡、过滤得到的溶液中可能含有其他还原性物质会消耗高锰酸钾,导致结果可能偏高。
本题难度:一般
2、计算题 实验欲配制6.00 mol/L的H2SO4溶液.现有三种不同浓度的硫酸:①240 mL 1.00 mol/L的硫酸;②150 mL 25.0%的硫酸(ρ=1.18 g/mL);③足量的18.00 mol/L的浓H2SO4.现有三种规格容量瓶:250 mL、500 mL、1000 mL.配制要求:①、②两种硫酸全部用完,不足部分由③补充.试回答:
(1)选用容量瓶的规格是?。
(2)需要18.0 mol·L-1 H2SO4(aq)的体积是?。
参考答案:(1)1000 mL (2)295 mL
本题解析:(1)①25.0%的H2SO4溶液的物质的量浓度为:
c2(H2SO4)=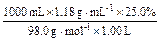 =3.01 mol·L-1
=3.01 mol·L-1
①、②两溶液的体积和约为:
V1+V2=240 mL+150 mL=390 mL
因①、②两溶液的浓度都小于6.00 mol·L-1,所以250 mL的容量瓶不可用。
②设配制500 mL 6.00 mol·L-1H2SO4(aq)需浓H2SO4的体积为x,则
0.500 L×6.00 mol·L-1=0.240 L×1.00 mol·L-1+0.150 L×3.01 mol·L-1+x×10-3 L×18.0 mol·L-1
解得:x=128
因为:128+240+150=518>500
所以,500 mL容量瓶也不能用.
(2)设配制1000 mL 6.00 mol·L-1 H2SO4(aq)需浓H2SO4的体积为y,则:1.000 L×6.00 mol·L-1=0.240 L×1.00 mol·L-1+0.150 L×3.01 mol·L-1+y×10-3 L×18.0 mol·L-1
解得:y=295 mL。
本题难度:简单
3、实验题 (16分)为了研究某土壤样品的酸碱性,某同学25℃时做了如下实验:①取m g土壤于烧杯中,加入VmL的蒸馏水,充分搅拌,静置后过滤,测定滤液的pH。②向滤液中滴加氨水,每加入2 mL氨水就搅拌均匀并测量溶液的pH。根据所得实验记录,以加入的氨水体积为横坐标、pH为纵坐标绘制曲线图如下:
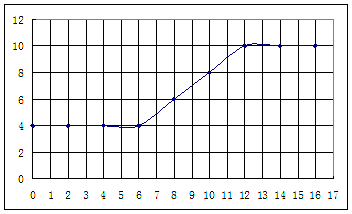
利用上述记录的数据,回答下列问题:(1)所测土壤显 性(填酸、碱、中)(2)已知25℃时, 所用氨水的浓度= 6.0?10-4mol/L,氨水的电离常数K = ?,为使该滤液呈中性,所加入氨水的恰当体积是?。(4)电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率变化可以确定滴定反应的终点。下列示意图中,曲线①是用NH3·H2O溶液滴定HCl溶液时,滴加NH3·H2O溶液体积与溶液电导率的关系。请你继续在该图中画出用NH3·H2O溶液滴定CH3COOH溶液时的曲线。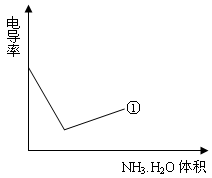
参考答案:(16分) (1) 酸性(2分),(2)?1.7?10-5mol/L,9 mL(8分)? (3)(6分)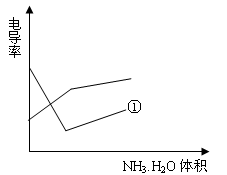
本题解析:略
本题难度:简单
4、实验题 (12分)某同学设计的制取氯气和验证氯气部分化学性质的实验装置如下图甲所示:

其中D处放有干燥的紫色石蕊试纸,E处放有湿润的紫色石蕊试纸, F、G处依次放有喷上少量淀粉KI溶液、浓NaOH溶液的棉球。回答下列问题:
(1)在装置A中放入有关药品后,打开活塞K,将分液漏斗中的液体加入烧瓶中,关闭分液漏斗的活塞,点燃酒精灯,请写出A处反应的离子方程式:
?
(2)B处饱和食盐水是为了除去?,C处浓硫酸的作用是?。
(3)实验中可观察到颜色的变化:D处?,E处?,F处?,G处棉球的作用是?,G处反应的离子方程式?。
(4)当F处棉球变色,立即关闭活塞K,可看到I瓶中液面上升,H瓶中充满黄绿色气体。则H瓶中加入的液体一般为?,甲中H—I装置的作用为?。若将甲中的H—I装置置换为乙装置,是否可行(填“是”或“否”)?,理由是?。
参考答案:(1)MnO2 + 4H+ + 2Cl- ="==" Mn2+ + Cl2↑ + 2H2O
(2)除去氯气中的氯化氢气体;干燥氯气
(3)仍为紫色;E处先变红后褪色;F处现象变蓝色;G处棉球的作用是吸收多余的氯气,Cl2 + 2OH-="=" Cl-+ ClO-+H2O
(4)水,收集多余的氯气,否,因为乙装置是一个密封装置,体积不能改变,压强增大时有危险
本题解析:略
本题难度:简单
5、简答题 【化学与技术】
将磷肥生产中形成的副产物石膏(CaSO4·2H2O)转化为硫酸钾肥料和氯化钙水合物储热材料,无论从经济效益、资源综合利用还是从环境保护角度看都具有重要意义。以下是石膏转化为硫酸钾和氯化钙的工艺流程示意图。
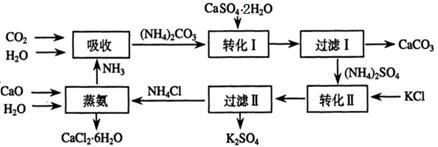
(1)本工艺中所用的原料除CaSO4·2H2O、KCl外,还需要?等原料。
(2)石膏悬浊液中加入碳酸铵溶液后发生反应的离子方程式为?。
(3)过滤Ⅰ操作所得固体中,除CaCO3外还含有?(填化学式)等物质,该固体可用作生产水泥的原料。
(4)检验过滤Ⅰ所得滤液中含有CO32-的方法是?。
(5)氯化钙结晶水合物(CaCl2·6H2O)是目前常用的无机储热材料,选择的依据是?。
a.熔点较低(29℃熔化)? b.能导电? c.能制冷? d.无毒
(6)上述工艺流程中体现绿色化学理念的是?。
参考答案:(1)CaCO3、NH3、H2O
(2)CaSO4+CO32-=CaCO3+SO42-?
(3)CaSO4
(4)滤液中滴加盐酸产生气泡?
(5)ad
(6)碳酸钙用于制取水泥原料、硫酸钙和氯化钾转化为硫酸钾和氯化钙、氨在工艺中循环使用等(原子利用率高,没有有害物质排放到环境中)
本题解析:(1)根据流程可知,需要生石灰、二氧化碳、氨气、水、碳酸钙高温分解即生成氧化钙和二氧化碳,所以本工艺中所用的原料除CaSO4·2H2O、KCl外,还需要CaCO3、NH3、H2O等原料。
(2)碳酸钙的溶解度小于硫酸钙,因此根据沉淀转化原理知,石膏悬浊液中加入碳酸铵溶液后发生的离子方程式为CaSO4+CO32-=CaCO3+SO42-。
(3)硫酸钙微溶于水,所以过滤I操作所得固体中,除CaCO3外还含有CaSO4等物质。
(4)由于碳酸盐能和盐酸反应产生二氧化碳气体,所以检验过滤I所得滤液中含有CO32-的方法是滤液中滴加盐酸产生的气泡。
(5)储热材料与物质的导电性以及能否制冷无关系,而与自身的熔点高低和有无毒性无关系,所以选ad。
(6)根据流程图知,工艺流程中体现绿色化学理念的是反应中产生的碳酸钙用于制取水泥原料、硫酸钙和氯化钾转化为硫酸钾和氯化钙、氨在工艺中循环使用等。
本题难度:一般