1、实验题 某课外活动小组设计了以下实验方案验证Cu与浓硝酸反应的过程中可能产生NO。其实验流程图如下:

(1)测定硝酸的物质的量?
反应结束后,从下图B装置中所得100mL溶液中取出25?.00mL溶液,用0.1mol?L-1的NaOH溶液滴定,用酚酞作指示剂,滴定前后的滴定管中液面的位置如右上图所示。在B容器中生成硝酸的物质的量为_____________?mol。?
(2)测定NO的体积?
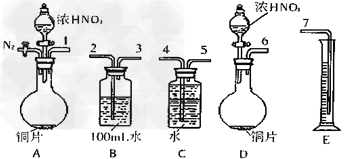
①从上图所示的装置中,你认为应选用___________装置进行Cu与浓硝酸反应实验,选用的理由是____________?。 ?
②选用上图所示仪器组合一套可用来完成实验并测定生成NO体积的装置,其合理的连接顺序是(填各导管口编号)_______________。 ?
③在测定NO的体积时,若量筒中水的液面比集气瓶的液面要低,此时应将量筒的位置?________________(“下降”或“升高”),以保证量筒中的液面与集气瓶中的液面持平。?
(3)气体成分分析:若实验测得NO的体积为112.0mL(已折算到标?准状况),则Cu与浓硝酸反应的过程中____________(填“有”或“没有”)NO产生,作此判断的依据是___________。?
(4)实验前,用托盘天平称取的铜片至少应为____________g。
2、实验题 医用氯化钙可用于生产补钙、抗过敏和消炎等药物。以工业碳酸钙(含有少量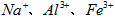 等杂质)生产医药级二水合氯化钙(
等杂质)生产医药级二水合氯化钙(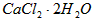 的质量分数为97.0%~103.0%)的主要流程如下
的质量分数为97.0%~103.0%)的主要流程如下

(1)除杂操作是加入氢氧化钙,调节溶液的pH为8.0~8.5,以除去溶液中的少量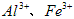 。检验
。检验 是否沉淀完全的试验操作是___________________。
是否沉淀完全的试验操作是___________________。
(2)酸化操作是加入盐酸,调节溶液的约pH为4.0,其目的有:
①将溶液中少量的 转化为
转化为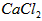 ;
;
②防止 在蒸发时水解;
在蒸发时水解;
③___________________。
(3)测定样品中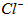 含量的方法是:
含量的方法是:
a.称取0.7500g样品,溶解,在250mL容量瓶中定容;
b.量取25.00mL待测溶液于锥形瓶中;
c.用0.05000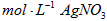 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液体积的平均值为20.39mL。
溶液体积的平均值为20.39mL。
①上述测定过程中需要溶液润洗的仪器有___________________。
②计算上述样品中 的质量分数为___________________。
的质量分数为___________________。
③若用上述办法测定的样品中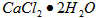 的质量分数偏高(测定过程中产生的误差可忽略),其可能原因有__________________;___________________。
的质量分数偏高(测定过程中产生的误差可忽略),其可能原因有__________________;___________________。
3、填空题 利用如图所示的装置和其他必要的仪器用品,完成下列实验。

(1)证明氨气具有还原性。已知2NH3+3CuO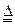 N2+3Cu+3H2O。
N2+3Cu+3H2O。
①碱石灰的作用是?,稀硫酸的作用是?。
②浓氨水与固体NaOH接触,为什么会逸出大量氨气??
?。
③证明NH3具有还原性的实验现象是?。
(2)用吸收了足量尾气的溶液制取少量硫酸亚铁铵晶体。
已知:硫酸亚铁铵是淡蓝绿色晶体,在空气中性质比较稳定。硫酸亚铁铵在水中的溶解度小于硫酸铵、硫酸亚铁。制备硫酸亚铁铵的化学方程式为:(NH4)2SO4+FeSO4+6H2O==(NH4)2 Fe(SO4)2·6H2O。若溶液的pH>8.1,Fe外将转化为沉淀。
①吸收了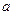 ?mol气体后,烧杯中的溶液能使酚酞变红。试依据“化学实验设计基本要求”设计制备硫酸亚铁铵溶液的方案,清简述实验方法。?
?mol气体后,烧杯中的溶液能使酚酞变红。试依据“化学实验设计基本要求”设计制备硫酸亚铁铵溶液的方案,清简述实验方法。?
?。
②为了从溶液中分离出硫酸亚铁铵晶体,还需要进行的实验操作是?。
4、实验题 工业上常用铁质容器盛装冷浓硫酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
[探究一]
(1)将已去除表面氧化物的铁钉(含少量碳元素)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是_________________。
(2)另称取铁钉6.0g放入15.0mL浓硫酸中,加热充分反应后得到溶液X并收集到气体Y。
①甲同学认为X中除Fe3+外还可能含有Fe2+。若要确认其中有Fe2+,应先用________(选填序号)。
a.KSCN溶液和氯水b.铁粉和KSCN溶液 c.浓氨水d.酸性KMnO4溶液
②乙同学取336mL(标准状况)气体Y通入足量溴水中,发生反应:SO2+Br2+2H2O=2HBr+H2SO4,然后加入足量 BaCl2溶液,经适当操作后得到干燥固体2.33g。由此推知气体Y中SO2的体积分数为____。
[探究二] 分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含有H2和CO2气体。为此设计了下列探究实验装置(图中夹持仪器省略)。
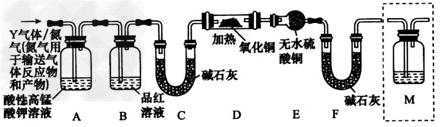
(3)装置B中试剂的作用是____________。
(4)认为气体Y中还含有CO2的理由是__________ (用化学方程式表示)。
(5)为确认CO2的存在,需在装置中添加M于____(填序号)。
a.A之前 b.A-B间 c.B-C间 d.C-D间
(6)如果气体Y中含有H2,预计实验现象应是___________________
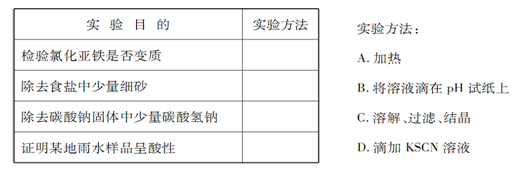
5、实验题 为了达到下 表所列的实验目的,请选择合适的实验方法,将其标号填在答题上。
表所列的实验目的,请选择合适的实验方法,将其标号填在答题上。