1、填空题 某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
(1)该反应的化学方程式为______.
(2)反应开始至2min,气体Z的平均反应速率为______mol?(L?min)-1.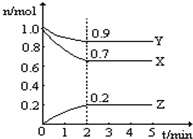
参考答案:(1)由图象可以看出,反应中X、Y的物质的量减小,Z的物质的量增多,则X、Y为反应物,Z为生成物,且△n(X):△n(Y):△n(Z)=0.3mol:0.1mol:0.2mol=3:1:2,则反应的化学方程式为:3X+Y

2Z,
故答案为:3X+Y

2Z;
(2)反应开始至2min时Z的平均反应速率为:c(Z)=0.2mol2L2min=0.05mol/(L?min),
故答案为:0.05.
本题解析:
本题难度:一般
2、填空题 (16分)某校高三同学高考前重做以下两个课本实验,请你回答实验过程中的相关问题:
(1)铝热反应实验:取磁性氧化铁粉按课本中的实验装置(如图)进行铝热反应,将反应
后所得“铁块”溶于盐酸,向反应后的溶液中滴加KSCN溶液,发现溶液变血红色。

①出现这种现象的原因,除了因“铁块”中可能混有没反应完的
磁性氧化铁外,还有一种可能原因是 。
② 若要证明反应所得“铁块”中含有金属铝,可用 (填化学式)溶液,所发生反应的离子方程式为 。
(2)化学反应速率影响因素的探究实验:
KI在经酸化的溶液中被空气氧化的反应式为:4H+ + 4I-+ O2 = 2I2 + 2H2O。该反应的速率受温度、酸度、溶剂、试剂浓度等影响,可用淀粉与碘的显色反应来观测该反应的速率。已知,淀粉与碘的显色反应在温度升高时灵敏度会降低,高于75℃则不能显色;淀粉浓度越高显色越灵敏、颜色也越深。
实验小组拟用0.8 mol·L-1 KI溶液、0.1 mol·L-1H2SO4溶液、淀粉溶液等来探究温度、酸度对上述反应速率的影响,他们做了A—C三组实验,部分实验数据如下表:
编号
| 温度/℃
| H2SO4体积/mL
| KI溶液体积/mL
| H2O体积/mL
| 淀粉溶液
/ mL
| 出现蓝色时间 /s
|
A
| 39
| 10
| 5
| 5
| 1
| 5
|
B
| TB
| 10
| 5
| 5
| 1
| 没出现蓝色
|
C
| 5
| 10
| 5
| 5
| 1
| 39
|
D
|
|
|
|
|
| t
|
①为确保A组实验在39℃下进行,应采用的控温操作方法是 。
②A—C三组实验时,都加入了5mL水,其目的是 。
③B组实验中“没出现蓝色”,原因是 。
④请你为小组设计D组实验方案(在表格空白处填入你设计的5个数据),以帮助小组完成探究目标。
⑤按你设计的实验数据,请你预测一个t值,并写出与你预测相对应的探究实验结
论 。
参考答案:(16分,每空2分)
(1)①生成的铁又有一部分被空气氧化
②NaOH(回答其它强碱也得分),2Al+2OH-+2H2O=2AlO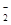 +3H2↑。
+3H2↑。
(2)①将量出的各种溶液分别装在试管中,再将试管全部放在同一水浴中加热,用温度计测量试管中溶液的温度
②为了在后续研究酸度因素对反应速率影响时保持KI和淀粉浓度不变(凡表达出“控制变量”、“对比实验”意思的各种合理答案都得分)
③温度(TB)高于75℃,淀粉与碘不显色。
D
39或5
10加减5范围内的一个数值
5
5减加5范围内的一个数值
1
④
(温度必须为39℃或5℃,KI溶液体积必须为5ml,淀粉溶液为1ml,水和硫酸溶液总体积为20ml的各种组合答案均得分)。
⑤设计酸体积<10mL时,t预测值要大于同温对比值;设计酸体积>10mL时,t预测值要小于同温对比值(合理范围内的数值都给1分)。结论为:酸度越大反应速率越快(1分)(若得出结论为:酸度越大反应速率越慢,不给分)。
本题解析:(1)①使KSCN溶液变红色说明溶液中存在铁离子,除铁块中含有未反应的磁性氧化铁外,另一原因是:因为该反应是在高温下进行的,生成的单质铁又与空气中的氧气发生氧化还原反应生成了氧化铁,与盐酸反应,溶液中有了铁离子而使KSCN溶液变红;
②证明铁块中含有铝,需选择强碱溶液如NaOH溶液,因为铁不与氢氧化钠溶液反应,而铝与氢氧化钠溶液反应产生气体;反应的离子方程式为2Al+2OH-+2H2O=2AlO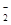 +3H2↑。
+3H2↑。
(2)①控制温度恒温的最好操作是水浴加热,具体操作是:将量出的各种溶液分别装在试管中,再将试管全部放在同一水浴中加热,用温度计测量试管中溶液的温度
②本实验的目的是探究温度、酸度对上述反应速率的影响,所以A—C三组实验时,都加入了5mL水,目的是为了在后续研究酸度因素对反应速率影响时保持KI和淀粉浓度不变;
③根据已知:淀粉与碘的显色反应在温度升高时灵敏度会降低,高于75℃则不能显色;所以B组实验中“没出现蓝色”,原因是温度高于75℃,淀粉与碘不显色。
④前三组实验的数据表明是在酸度相同时,探究温度对反应速率的影响,所以D组应是当温度相同时,探究酸度对反应速率的影响,乙组实验现象不正确,应舍弃,所以D组的温度与甲或丙是相同的,为保证淀粉的浓度是相同的,所以硫酸和水的总体积是15mL,再去改变硫酸溶液和水的体积来改变溶液的酸度,判断出现蓝色的时间,具体数据如下:
D
39或5
10加减5范围内的一个数值
5
5减加5范围内的一个数值
1
⑤依据酸的体积确定溶液的酸度,由4H+ + 4I-+ O2 = 2I2 + 2H2O可知,溶液酸度越大,生成碘的速率越快,与同温度的实验相比,看到蓝色的时间越短。
考点:考查铝热反应实验,反应速率的探究实验,对实验的分析判断
本题难度:困难
3、选择题 将1 mol CO和2 mol H2充入一容积为1 L的密闭容器中,分别在250℃、T℃下发生反应:CO(g)+2H2(g) CH3OH(g) ΔH=a kJ/mol,如图所示。下列分析中正确的是( )
CH3OH(g) ΔH=a kJ/mol,如图所示。下列分析中正确的是( )

A.250℃时,0~10 min H2反应速率为0.015 mol/(L·min)
B.平衡时CO的转化率:T℃时小于250℃时
C.其他条件不变,若减小容器体积,CO体积分数增大
D.a<0,平衡常数K:T℃时大于250℃
参考答案:D
本题解析:A项,甲醇的物质的量增加0.15 mol,则H2减小0.3 mol,v(H2)=0.03 mol/(L·min);B项,T℃达到平衡时甲醇物质的量大,则CO的转化率大;C项,减小体积相当于增大压强,平衡向正反应方向移动,CO的体积分数减小;D项,a<0即正反应放热,降温平衡向正反应方向移动,K值增大。
点拨:本题考查化学平衡,考查考生根据图像解题的能力。难度较大。
本题难度:一般
4、选择题 一定能加快反应速率的措施是( )
A.升高温度
B.降低温度
C.增大压强
D.增加反应物量
参考答案:A、升高温度,增加单位体积内的活化分子数,有效碰撞增加,反应速率加快,故A正确;
B、降低温度,降低增加单位体积内的活化分子数,有效碰撞减少,反应速率减慢,故B错误;
C、增大压强对有气体参加的反应,反应速率加快,若没有气体参加,压强对反应速率不影响,故C错误;
D、增加反应物的物质的量,反应物的浓度不一定变化,如固体、纯液体,反应速率不一定加快,故D错误;
故选A.
本题解析:
本题难度:简单
5、计算题 将对H2相对密度为3.6 的N2与H2组成的混合气0.5 mol 通入一恒容密闭容器中,一定条件下发生反应,平衡时容器内压强比反应前少了24%。求:
(1) 反应前混合气中N2和H2的质量比。
(2) 平衡混合气中,含氨的体积分数。
(3) 平衡时N2、H2的转化率。
参考答案:(1)7∶2(2)31.6%。
(3)N2、H2的转化率分别为60%和40%。
本题解析:这种题首先要利用相对密度求出混合气的平均相对分子量为 7.2,利用十字交叉法求出N2、H2的物质的量比为1∶4,从而得出N2、H2的质量比为 7∶2。然后设未知数列出下列平衡计算模式:
N2(g)?+? 3H2(g)?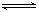 ?2NH3(g)
?2NH3(g)
n 0(mol)?0.4?+? 0.1?+? 0?=? 0.5
n变(mol)? 3x?x? 2x
n平(mol) ?0.4-3x?+? 0.1-x?+?2x?=? 0.5-2x
根据压强与物质的量成正比,可得出2x = 0.12 mol,即可求出NH3的体积分数为31.6%。最后可求出N2、H2的转化率分别为60%和40%。
本题难度:一般