1、选择题 在一定温度下的定容密闭容器中,当下列物理量不再改变时,表明反应:A(s)+2B(g)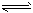 C(g)+D(g) 已达平衡标志的是
C(g)+D(g) 已达平衡标志的是
[? ]
A.混合气体的压强
B.混合气体的密度
C.B物质的分子量
D.气体的总物质的量
参考答案:B
本题解析:
本题难度:一般
2、选择题 可逆反应在2A(g)+3B(g)?3C(g)一定条件下,使一定量的A和B反应达到平衡状态时,下列说法正确的是( )
A.平衡混合物的体积是反应刚开始时的
B.平衡混合物中各物质的浓度比为2:3:3
C.单位时间内若消耗了a?mol?A,必须同时也消耗了1.5a?mol的C
D.平衡混合物中各物质的浓度相等
参考答案:A.由于起始量未知,且不知平衡常数,不能用平衡混合物的体积是反应刚开始时的35作为判断是否平衡的依据,故A错误;
B.平衡混合物中各物质的浓度比为2:3:3不能用以判断是否达到平衡状态,与起始配料比以及反应的转化程度有关,故B错误;
C.单位时间内若消耗了amolA,必须同时也消耗了1.5amol的C,说明正逆反应速率相等,故C正确;
D.平衡混合物中各物质的浓度相等不能判断是否达到平衡状态,与起始配料比以及反应的转化程度有关,故D错误.
故选C.
本题解析:
本题难度:简单
3、选择题 工业制硫酸的反应之一是:2SO2+O2
2SO3.如果反应在密闭容器中进行,下列说法错误的是( )
A.当SO2的物质的量不再改变时,该反应达到了平衡状态
B.达到平衡时,SO2的浓度与SO3的浓度一定相等
C.在给定条件下达平衡时,SO2的转化率达到了最大
D.使用V2O5催化剂是为了加快反应速率,提高生产效率
参考答案:A.当可逆反应达到平衡状态时,各物质的物质的量浓度不再改变,所以当SO2的物质的量不再改变时,该反应达到了平衡状态,故A正确;
B.当该反应达到平衡状态时,SO2的浓度与SO3的浓度可能相等,也可能不等,与反应物浓度及转化率有关,故B错误;
C.在给定条件下达平衡状态时,二氧化硫的正逆反应速率相等,所以SO2的转化率达到了最大,故C正确;
D.催化剂能增大反应速率,缩短反应时间,但不改变化学平衡状态移动,故D正确;
故选B.
本题解析:
本题难度:简单
4、选择题 一定条件下,在密闭容器中,能表示反应X(g)+2Y(g)?2Z(g),一定达到化学平衡状态的是( )
①X、Y、Z的物质的量之比为1:2:2
②X、Y、Z的浓度不再发生变化
③容器中的压强不再发生变化
④单位时间内生成n?mol?Z,同时生成2n?mol?Y.
A.①②
B.①④
C.②③
D.③④
参考答案:①平衡时各物质的物质的量取决于起始配料比以及转化的程度,不能作为判断是否达到平衡状态的依据,故①错误;
②X、Y、Z的浓度不再发生变化,说明达到化学平衡状态,故②正确;
③反应物和生成物的物质的量不相等,当压强不变时,说明各物质的量不再发生变化,反应达到平衡状态,故③正确;
④单位时间内生成nmolZ,同时生成2nmolY,正逆反应速率不相等,没有达到平衡状态,故④错误.
故选C.
本题解析:
本题难度:简单
5、填空题 (12分)为减弱温室效应,除了减少CO2的排放、植树造林、将液态CO2注入深海等措施外,还有一种思路是将CO2转化成其它可燃物质。如工业上已实现CO2和H2反应生成甲醇的转化。已知:在一恒温、恒容密闭容器中充入l mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g) =CH3OH(g)+H2O(g)


 ?△H= -49.0 kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如下图所示。请回答
?△H= -49.0 kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如下图所示。请回答 :
:
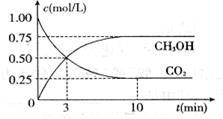
(1)达到平衡的时刻是____________min(填“3”或“10”)。 在前10min内,用CO2表示的反应速率
在前10min内,用CO2表示的反应速率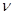 (CO2)="________"
(CO2)="________"
(2)能判断该反应达到化学平衡状态的依据是??。
 a.容器压强不变? b.混合气体中c(CO2)不变
a.容器压强不变? b.混合气体中c(CO2)不变
c.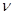 (CH3OH)=
(CH3OH)= 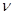 (H2O)? d.c(CH3
(H2O)? d.c(CH3 OH)=c(H2O)
OH)=c(H2O)
 (3)为了提高H2的转化率,可采取__________(填“增大”或“减小”)CO2浓度的措施。
(3)为了提高H2的转化率,可采取__________(填“增大”或“减小”)CO2浓度的措施。
(4)达平衡后,H2的转化率是_____________。平衡常数K=____________。(计算结果保留一位小数)
参考答案:(每空2分,共12分)
(1) _____10_? ___min(填“3”或“10”);____0.075_?_ mol/(L·min)。
(2)? a  b?;
b?;
(3)?增大?_(填“增大”或“减小”);
(4)转化率是_____75%______,平衡常数K=_______5.3_______。(计算结果保留一位小数)
本题解析:略
本题难度:一般