| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点整理《热化学方程式》高频考点预测(2019年最新版)(八)
参考答案:A 本题解析:根据题意可知①C2H4(g)+3O2(g)=2H2O(l)+2CO2(g) △H=-1411.0kJ·mol-1、②C2H5OH(1)+3O2(g)=3H2O(l)+2CO2(g) △H=-1366.8 kJ·mol-1,所以根据盖斯定律可知,①-②即得到C2H4(g)+H2O(l)=C2H5OH(l),所以反应热是-1411.0kJ·mol-1+366.8 kJ·mol-1=-44.2 kJ·mol-1,答案选A 本题难度:一般 2、选择题 已知充分燃烧ag乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量bkJ,则乙炔燃烧的热化学方程 式正确的是 参考答案:C 本题解析: 本题难度:简单 3、填空题 全球气候变暖已经成为全世界人类面临的重大问题。 |
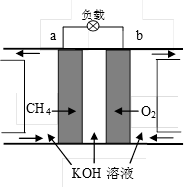
参考答案:(1)6CO2(g)+6H2O(l)=C6H12O6(葡萄糖、s)+6O2(g) △H=+2880kJ·mol-1
(2)①0.225;②75%;③5.33 (L2/mol2);④CD;⑤<;
(3)①O2+2H2O+4e-=4OH-;②减小;③大于
本题解析:(1)由盖斯定律可知:6CO2(g)+6H2O(l)=C6H12O6(葡萄糖、s)+6O2(g) △H="6×(+396" kJ/mol)+6×(+284 kJ/mol)+(-1200 kJ/mol)=+2880kJ·mol-1;(2)由图象可知有反应开始到平衡平均反应速率v(CO2)=0.75mol/L÷10min=0.075mol·L-1·min-1,故①v(H2)="3" v(CO2)=" 0.225" mol·L-1·min-1;②氢气的转化率=3×0.75mol÷3mol×100%=75%,③求此温度下该反应的平衡常数K=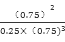 =5.33(L2/mol2);④1L恒容容器中CO2(g)+3H2(g)
=5.33(L2/mol2);④1L恒容容器中CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-49.0kJ/mol反应,升高温度平衡逆向移动,n(CH3OH)/n(CO2)减小;充入He(g),使体系压强增大平衡不移动,故n(CH3OH)/n(CO2)不变;将H2O(g)从体系中分离出去,则平衡向正向移动,故n(CH3OH)/n(CO2)增大;再充入1mol CO2和3mol H2相当于两个等效的平衡体系合,合并瞬间n(CH3OH)/n(CO2)不变,平衡正向移动则n(CH3OH)/n(CO2)增大;故选CD。⑤当反应达到平衡时,H2的物质的量浓度为c1,然后向容器中再加入一定量H2,待反应再一次达到平衡后,H2的物质的量浓度为c2,根据勒夏特列原理可知c1<c2。(3)由图象可知,该电池为甲烷燃料电池,通甲烷的一方为负极:CH4-8e—+10OH—= CO32—+7H2O,通氧气的一方为正极:2O2+4H2O+8e-=8OH-,随着电池不断放电,电解质溶液的pH减小,通常情况下,甲烷燃烧会有一部分能量以光能形式释放,则甲烷燃料电池的能量利用率大于甲烷燃烧的能量利用率。
CH3OH(g)+H2O(g)△H=-49.0kJ/mol反应,升高温度平衡逆向移动,n(CH3OH)/n(CO2)减小;充入He(g),使体系压强增大平衡不移动,故n(CH3OH)/n(CO2)不变;将H2O(g)从体系中分离出去,则平衡向正向移动,故n(CH3OH)/n(CO2)增大;再充入1mol CO2和3mol H2相当于两个等效的平衡体系合,合并瞬间n(CH3OH)/n(CO2)不变,平衡正向移动则n(CH3OH)/n(CO2)增大;故选CD。⑤当反应达到平衡时,H2的物质的量浓度为c1,然后向容器中再加入一定量H2,待反应再一次达到平衡后,H2的物质的量浓度为c2,根据勒夏特列原理可知c1<c2。(3)由图象可知,该电池为甲烷燃料电池,通甲烷的一方为负极:CH4-8e—+10OH—= CO32—+7H2O,通氧气的一方为正极:2O2+4H2O+8e-=8OH-,随着电池不断放电,电解质溶液的pH减小,通常情况下,甲烷燃烧会有一部分能量以光能形式释放,则甲烷燃料电池的能量利用率大于甲烷燃烧的能量利用率。
考点:化学反应能量、化学平衡、电化学等反应原理考查。
本题难度:困难
4、填空题 火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态过氧化氢(H2O2)。当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出256.7kJ的热量(相当于25℃、101 kPa下测得的热量)。
又知H2O(l)=H2O(g) ΔH=+44kJ/mol。
(1)写出过氧化氢(H2O2)的结构式 。
(2)液态肼与液态过氧化氢反应生成液态水反应的热化学方程式为 。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是______ 。
参考答案: (1) H-O-O-H
(2) N2H4(l)+2H2O2(l)=N2(g)+4H2O(l) △H=-817.75817.75kJ/mol
(3)产物无污染
本题解析:(1)过氧化氢是还与极性键和非极性键的共价化合物,结构式是H-O-O-H。
(2)0.4 mol液态肼与足量的液态H2O2反应生成氮气和水蒸气,放出256.7 kJ的热量,则1mol液态肼与足量的液态H2O2反应生成氮气和水蒸气,放出256.7kJ÷0.4=641.75kJ。又因为生成的4mol水蒸气变成液态水有放出44kJ/mol×4mol=176kJ,所以该反应的反应热是641.75kJ/mol+176kJ/mol=-817.75KJ.mol-1,则热化学方程式是NN2H4(l)+2H2O2(l)=N2(g)+4H2O(l) △H=-817.75kJ/mol。
(3)根据反应的化学方程式可知,生成物是氮气和水,对环境无污染。
本题难度:一般
5、填空题 (16分)碳酸甲乙酯(CH3OCOOC2H5)是一种理想的锂电池有机电解液,生成碳酸甲乙酯的原理为:C2H5OCOOC2H5(g)+ CH3OCOOCH3(g) 2 CH3OCOOC2H5(g) ΔH1
2 CH3OCOOC2H5(g) ΔH1
(1)其他条件相同,CH3OCOOCH3的平衡转化率(α)与温度(T)、反应物配比(R)的关系如图所示。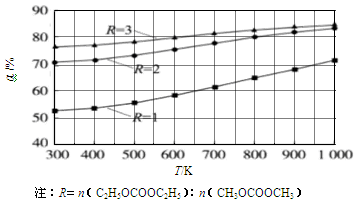
①ΔH1______0(填“<”、“=”或“>”)。
②由图可知,为了提高CH3OCOOCH3的平衡转化率,除了升温,另一措施是___________。
③在密闭容器中,将1mol C2H5OCOOC2H5和1mol CH3OCOOCH3混合加热到650K,利用图中的数据,求此温度下该反应的平衡常数K(请写出计算过程)。
(2)已知:CH3OCOOCH3(g) + C2H5OH(g) CH3OCOOC2H5(g) + CH3OH(g) ΔH2
CH3OCOOC2H5(g) + CH3OH(g) ΔH2
CH3OCOOC2H5(g) + C2H5OH(g) C2H5OCOOC2H5(g) + CH3OH(g) ΔH3
C2H5OCOOC2H5(g) + CH3OH(g) ΔH3
ΔH1=____________________(用ΔH2和ΔH3表示)
(3)已知上述反应需要催化剂,请在答题卡的坐标图中,画出有催化剂与无催化剂两种情况下反应过程中体系能量变化示意图,并进行必要标注。
参考答案:(1)① >(2分)② 增大反应物中C2H5OCOOC2H5的浓度(或比例)(2分)
③由图知,平衡时CH3OCOOCH3的转化率为60%。(1分)
设容器的容积为V(L)
C2H5OCOOC2H5(g)+ CH3OCOOCH3(g) 2CH3OCOOC2H5(g)
2CH3OCOOC2H5(g)
初始浓度/ mol·L-1: 1/V 1/V 0
平衡浓度/ mol·L-1: 0.4/V 0.4/V 1.2/V (2分)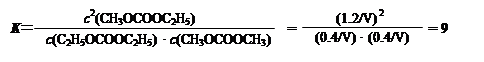
 (3分)
(3分)
(2)ΔH2-ΔH3(3分) (3)(3分)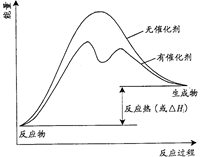
本题解析:(1)①根据图像变化可知,在反应物配比相同的条件下,温度越高,CH3OCOOCH3的平衡转化率越大,这说明升高温度平衡向正反应方向进行,因此该反应的正反应为吸热反应,即△H>0;
②根据图像变化可知,在温度相同的条件下,R越大,CH3OCOOCH3的平衡转化率越大,因此除升温外,还可增大反应物中C2H5OCOOC2H5的浓度(或比例);
③由图知,R=1,650K,达到平衡时CH3OCOOCH3的转化率为60%。设容器的容积为V(L),则
C2H5OCOOC2H5(g)+ CH3OCOOCH3(g) 2CH3OCOOC2H5(g)
2CH3OCOOC2H5(g)
初始浓度/ mol·L-1: 1/V 1/V 0
平衡浓度/ mol·L-1: 0.4/V 0.4/V 1.2/V
所以该温度下平衡常数K=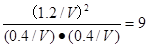
(2)已知①CH3OCOOCH3(g)+C2H5OH(g) CH3OCOOC2H5(g)+CH3OH(g)△H2,②CH3OCOOC2H5(g)+C2H5OH(g)
CH3OCOOC2H5(g)+CH3OH(g)△H2,②CH3OCOOC2H5(g)+C2H5OH(g) C2H5OCOOC2H5(g)+CH3OH(g)△H3,则根据盖斯定律可知,①-②可得C2H5OCOOC2H5(g)+CH3OCOOCH3(g)
C2H5OCOOC2H5(g)+CH3OH(g)△H3,则根据盖斯定律可知,①-②可得C2H5OCOOC2H5(g)+CH3OCOOCH3(g) 2CH3OCOOC2H5(g),所以反应热△H1=△H2-△H3;
2CH3OCOOC2H5(g),所以反应热△H1=△H2-△H3;
(3)催化剂不影响平衡状态和反应热,但催化剂降低反应所需的活化能,即可反应速率,因此有催化剂与无催化剂两种情况下反应过程中体系能量变化示意图可表示为 。
。
考点:考查外界条件对平衡状态的影响、化学平衡图像分析以及平衡状态和反应热的有关计算等
本题难度:困难
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点总结《无机综合与.. | |