1、选择题 如图表示某可逆反应在使用和未使用催化剂时,反应进程和能量的对应关系。下列说法一定正确的是
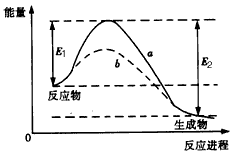
[? ]
A.a与b相比,b的活化能更高
B.反应物断键吸收的总能量小于生成物成键释放的总能量
C.a与b相比,反应的平衡常数一定不同
D.a与b相比,a对应的反应速率更快
参考答案:B
本题解析:
本题难度:一般
2、填空题 固定和利用CO2能有效地利用资源,并减少空气中的温室气体。工业上有一种用CO2来生产甲醇燃料的方法:CO2(g)+3H2(g)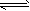 CH3OH(g)+H2O(g) △H=-49.0 kJ·mol-1 某同学实验将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如下图所示(实线)。
CH3OH(g)+H2O(g) △H=-49.0 kJ·mol-1 某同学实验将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如下图所示(实线)。
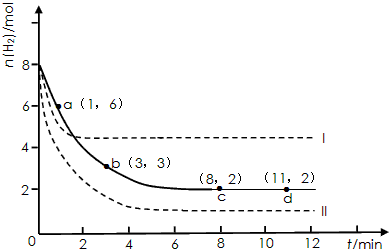
(1)a点正反应速率_______(填大于、等于或小于)逆反应速率。
(2)下列时间段平均反应速率最大的是___________。
A.0~1min B.1~3min C.3~8min D.8~11min
(3)仅改变某一实验条件再进行两次实验,测得H2的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变是___________,曲线II对应的实验条件改变是___________。
参考答案:(1)大于
(2)A
(3)升高温度;增大压强
本题解析:
本题难度:一般
3、填空题 氯气在298 K、100 kPa时,在1 L水中可溶解0. 09 mol,实验测得溶于水的Cl2约有三分之一与水反应。请回答下列问题:
(1)该反应的离子方程式为________________;
(2)估算该反应的平衡常数_____________ (列式计算);
(3)在上述平衡体系中加入少量NaOH固体,平衡将向_____________移动;
(4)如果增大氯气的压强,氯气在水中的溶解度将_________ (填“增大”、“减小”或“不变”),平衡将向________ 移动。
参考答案:(1)Cl2+H2O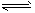 H++Cl-+HClO (2)
H++Cl-+HClO (2)
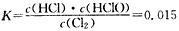 (3)正反应方向
(3)正反应方向
(4)增大;正反应方向
本题解析:
本题难度:一般
4、 填空题 t℃时,将3molA和2molB气体通入体积为2L的密闭容器中(容积不变),发生如下反应:3A?(g)+B?(g)?

?x?C(g),2min时反应达到平衡状态(温度不变),剩余1.8molB,并测得C的浓度为0.4mol/L,请填写下列空白:
(1)v(B)=______mol/(L?min),v(C)=______mol/(L?min),x=______.
(2)比较达到平衡时,A、B两反应物的转化率之比为α(A):α(B)=______;
(3)若继续向原平衡混合物的容器中通入少量氦气(氦气和A、B、C都不反应)后,下列说法中正确的是______(填写字母序号)
A.化学平衡向正反应方向移动?B.化学平衡向逆反应方向移动
C.化学平衡不会发生移动?D.正、逆反应的化学反应速率保持不变.
参考答案:据三段式解题法,求出反应混合物各组分的物质的量的变化量、平衡时组分的物质的量.
平衡时,c的物质的量为2L×0.4mol/L=0.8mol,
?3A?(g)+B?(g)?

?x?C(g),
开始(mol):3? 2? 0
变化(mol):0.6?2-1.8=0.2?0.8
平衡(mol):2.4?1.8? 0.8
(1)v(B)=△n(B)V△t=0.2mol2L2min=0.05mol/(L?min);
v(C)=△n(C)V△t=0.8mol2L2min=0.2mol/(L?min);
化学计量数之比等于物质的量之比,所以1:x=0.2mol:0.8mol,解得x=4,
故答案为:0.05;0.2;4;
(2)α(A)=0.6mol3mol×100%=20%,
α(B)=0.2mol2mol×100%=10%,
所以α(A):α(B)=20%:10%=2:1,
故答案为:2:1;
(3)向容器中通入少量氦气,不影响反应混合物各组分的浓度,正逆反应速率不变,平衡不移动.
故选:CD.
本题解析:
本题难度:一般
5、选择题 一定温度下,在一容积固定的密闭容器中,建立了下列平衡:2NO2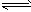 N2O4,恒温下,再向容器通入一定量N2O4,重新建立平衡后,容器中N2O4的体积分数
N2O4,恒温下,再向容器通入一定量N2O4,重新建立平衡后,容器中N2O4的体积分数
[? ]
A.减少
B.增大
C.不变
D.无法判断变化情况
参考答案:B
本题解析:
本题难度:一般