1、选择题 设C(s)+CO2(g)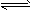 2CO(g) △H1>0 反应速率为v1;设N2(g)+3H2(g)
2CO(g) △H1>0 反应速率为v1;设N2(g)+3H2(g)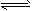 2NH3(g) △H2<0 反应速率为
2NH3(g) △H2<0 反应速率为
v2。对于上述反应,当温度降低时,v1和v2的变化情况为
[? ]
A.同时增大
B.同时减小
C.v1增大,v2减小
D.v1减小,v2增大
2、填空题 工业上以黄铁矿为原料生产硫酸,其中重要的一步是催化氧化(生产中保持恒温恒容条件):2SO2(g)+O2?(g)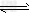 2SO3(g)?△H=-196.6?kJ·mol-1
2SO3(g)?△H=-196.6?kJ·mol-1
⑴生产中为提高反应速率和SO2的转化率,下列措施可行的是_______(填字母,下同)。
A.向装置中充入N2?
B.向装置中充入过量的SO2
C.向装置中充入O2?
D.升高温度
⑵若在一定温度下,向一个容积可变的恒压容器中,通入3mol?SO2?和2mol?O2?及固体催化剂,发生上述反应,平衡时容器内气体体积为起始时的90%。保持同一反应温度,在相同容器中,将起始物质的量改为?5mol?SO2(g)、3.5?mol?O2(g)、1mol?SO3(g)?,下列说法正确的是___________
A.第一次平衡时反应放出的热量为294.9kJ?
B.两次平衡SO2的转化率相等
C.两次平衡时的O2体积分数相等?
D.第二次平衡时SO3的体积分数等于2/9
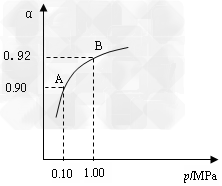
⑶生产中在550?℃时,将2.0?mol?SO2和1.0?mol?O2置于 5?L密闭容器中,SO2转化为SO3的平衡转化率(α)与体系总压强(p)的关系如图所示。反应达平衡后,体系总压强为
0.10?M?Pa。试计算反应 2SO3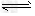 2SO2+O2?在550?℃时的平衡常数K=_________。 A、B表示不同压强下的平衡转化率,通常工业生产中采用常压的原因是:__________________,并比较不同压强下的平衡常数:K(0.10?MPa)?_________K(1.0?MPa)(填?“<”或“>”或“=”)。
2SO2+O2?在550?℃时的平衡常数K=_________。 A、B表示不同压强下的平衡转化率,通常工业生产中采用常压的原因是:__________________,并比较不同压强下的平衡常数:K(0.10?MPa)?_________K(1.0?MPa)(填?“<”或“>”或“=”)。
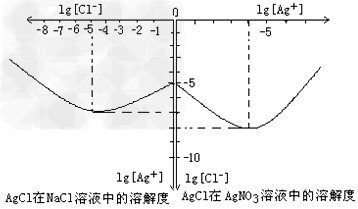
⑷沉淀物并非绝对不溶,且在水及各种不同的溶液中溶解度有所不同,同离子效应、络合物的形成等都会使沉淀物的溶解度有所改变。已知AgCl?+?Cl-?=[AgCl2]-,下图是某温度下AgCl在NaCl溶液中的溶解情况。由以上信息可知:
①由图知该温度下AgCl的溶度积常数为__________________________。
②AgCl在NaCl溶液中的溶解出现如图所示情况(先变小后变大)的原因是:__________________________?
3、选择题 对于反应:N2+3H2 2NH3(正反应为放热反应),下列图象所示不正确的是
2NH3(正反应为放热反应),下列图象所示不正确的是
[? ]
A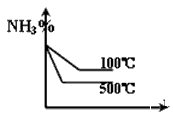
B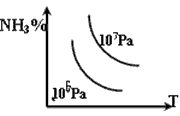
C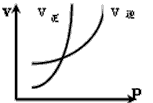
D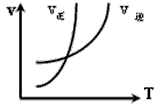
4、选择题 对苯二酚是摄影业中常用显影剂,它在水中电离出的阴离子对已曝光的AgBr有显影作用,有关变化可表示为:
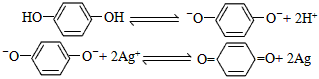
|
则在以对苯二酚为主要成分的显影液中,能使显影速度明显加快的添加剂是
[? ]
A.KBr
B.CH3COOH
C.Na2CO3
D.H2O
5、简答题 在一密闭容器中,反应2SO2(g)+O2(g)═2SO3(g)+Q(Q>0)达到平衡.完成下列填空:
(1)升高温度,平衡向______方向移动(选填“正反应”或“逆反应”).在工业生产中反应温度控制在400~500℃,主要是因为______.
(2)欲使SO2转化率增大,可采取的措施有______、______.
(3)若容器容积为2L,开始加入的SO2为0.1mol,20s后测得SO3的物质的量为0.08mol,则O2的平均反应速率为______mol/(L?s).