1、简答题 某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.
| 实验编号 | 反应物 | 催化剂
①
10mL2%?H2O2溶液
无
②
10mL5%?H2O2溶液
无
③
10mL5%?H2O2溶液
1mL0.1mol?L-1FeCl3溶液
④
10mL5%?H2O2溶液+少量HCl溶液
1mL0.1mol?L-1FeCl3溶液
⑤
10mL5%?H2O2溶液+少量NaOH溶液
1mL0.1mol?L-1FeCl3溶液
|
(1)催化剂能加快化学反应速率的原因是______.
(2)常温下5%?H2O2溶液的pH约为6,H2O2的电离方程式为______.
(3)实验①和②的目的是______.实验时由于没有观察到明显现象而无法得出结论.资料显示,通常条件下H2O2稳定,不易分解.为了达到实验目的,你对原实验方案的改进是______.
(4)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图.
分析上图能够得出的实验结论是______.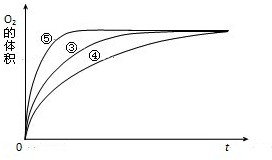
2、选择题 可逆反应2A(g)+2B(g)?C(g)+3D(g),在不同情况下测得下列四种反应速率,其中反应最快的是( )
A.υ(C)=0.25mol/(L?s)
B.υ(B)=0.4mol/(L?s)
C.υ(A)=0.6mol/(L?s)
D.υ(D)=0.8mol/(L?s)
3、选择题 化工生产中,为加快反应速率应优先考虑的措施是
[? ]
A.选用适宜的催化剂
B.采用高压
C.采用高温
D.增大反应物浓度
4、实验题 Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物。现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响。
[实验设计] 控制p-CP的初始浓度相同,恒定实验温度在298 K或313 K(其余实验条件见下表),设计如下对比实验。
(1)请完成以下实验设计表(表中不要留空格)。
实验编号
| 实验目的
| T/K
| pH
| c/10-3 mol·L-1
|
H2O2
| Fe2+
|
①
| 为以下实验作参照
| 298
| 3
| 6.0
| 0.30
|
②
| 探究温度对降解反应速率的影响
| ?
| ?
| ?
| ?
|
③
| ?
| 298
| 10
| 6.0
| 0.30
|
?
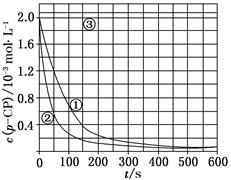
[数据处理] 实验测得p-CP的浓度随时间变化的关系如上图。
(2)请根据上图实验①曲线,计算降解反应50~150 s内的反应速率:
v(p-CP)=________mol·L-1·s-1。
[解释与结论]
(3)实验①、②表明温度升高,降解反应速率增大。但温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因:_____________________________
(4)实验③得出的结论是:pH等于10时,________。
[思考与交流]
(5)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来。根据上图中的信息,给出一种迅速停止反应的方法:________。
5、选择题 已知?4NH3(气)+5O2(气)=4NO(气)+6H2O(气),若反应速率分别是V(NH3)、V(O2)、V(NO)、V(H2O)[mol/L?min]表示,则正确的关系是( )
A.
V(NH3)=V(O2)
B.V(O2)=V(H2O)
C.V(NH3)=V(H2O)
D.V(O2)=V(NO)