1、简答题 某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.
| 实验编号 | 反应物 | 催化剂
①
10mL2%?H2O2溶液
无
②
10mL5%?H2O2溶液
无
③
10mL5%?H2O2溶液
1mL0.1mol?L-1FeCl3溶液
④
10mL5%?H2O2溶液+少量HCl溶液
1mL0.1mol?L-1FeCl3溶液
⑤
10mL5%?H2O2溶液+少量NaOH溶液
1mL0.1mol?L-1FeCl3溶液
|
(1)催化剂能加快化学反应速率的原因是______.
(2)常温下5%?H2O2溶液的pH约为6,H2O2的电离方程式为______.
(3)实验①和②的目的是______.实验时由于没有观察到明显现象而无法得出结论.资料显示,通常条件下H2O2稳定,不易分解.为了达到实验目的,你对原实验方案的改进是______.
(4)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图.
分析上图能够得出的实验结论是______.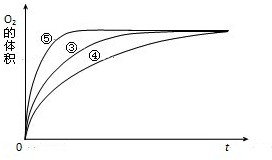
参考答案:(1)催化剂改变反应的途径,降低反应所需的活化能,从而加快反应速率,故答案为:降低了活化能;
(2)pH约为6,则电离生成氢离子,溶液显酸性,其电离方程式为H2O2?H++HO2-,故答案为:H2O2?H++HO2-;
(3)实验①和②的浓度不同,则该实验的目的为探究浓度对化学反应速率的影响;为了便于比较,应在相同的条件下利用一个变量来比较,
则向反应物中加入等量同种催化剂(或将盛有反应物的试管放在同一热水浴中),
故答案为:探究浓度对反应速率的影响;向反应物中加入等量同种催化剂(或将盛有反应物的试管放在同一热水浴中);
(4)由图可知,⑤的反应速率最大,④的反应速率最小,结合实验方案可知,碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率,
故答案为:碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率.
本题解析:
本题难度:一般
2、选择题 可逆反应2A(g)+2B(g)?C(g)+3D(g),在不同情况下测得下列四种反应速率,其中反应最快的是( )
A.υ(C)=0.25mol/(L?s)
B.υ(B)=0.4mol/(L?s)
C.υ(A)=0.6mol/(L?s)
D.υ(D)=0.8mol/(L?s)
参考答案:都转化为D物质表示的速率进行比较,
A、υ(C)=0.25mol/(L?s),速率之比等于化学计量数之比,故υ(D)=3υ(C)=3×0.25mol/(L?s)=0.75mol/(L?s);
B、υ(B)=0.4mol/(L?s),速率之比等于化学计量数之比,故υ(D)=32υ(B)=32×0.4mol/(L?s)=0.6mol/(L?s);
C、υ(A)=0.6mol/(L?s)),速率之比等于化学计量数之比,故υ(D)=32υ(A)=32×0.6mol/(L?s)=0.9mol/(L?s);
D、υ(D)=0.8mol/(L?s);
故选C.
本题解析:
本题难度:简单
3、选择题 化工生产中,为加快反应速率应优先考虑的措施是
[? ]
A.选用适宜的催化剂
B.采用高压
C.采用高温
D.增大反应物浓度
参考答案:A
本题解析:
本题难度:简单
4、实验题 Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物。现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响。
[实验设计] 控制p-CP的初始浓度相同,恒定实验温度在298 K或313 K(其余实验条件见下表),设计如下对比实验。
(1)请完成以下实验设计表(表中不要留空格)。
实验编号
| 实验目的
| T/K
| pH
| c/10-3 mol·L-1
|
H2O2
| Fe2+
|
①
| 为以下实验作参照
| 298
| 3
| 6.0
| 0.30
|
②
| 探究温度对降解反应速率的影响
| ?
| ?
| ?
| ?
|
③
| ?
| 298
| 10
| 6.0
| 0.30
|
?
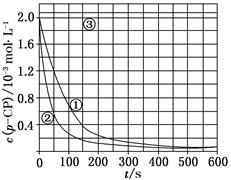
[数据处理] 实验测得p-CP的浓度随时间变化的关系如上图。
(2)请根据上图实验①曲线,计算降解反应50~150 s内的反应速率:
v(p-CP)=________mol·L-1·s-1。
[解释与结论]
(3)实验①、②表明温度升高,降解反应速率增大。但温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因:_____________________________
(4)实验③得出的结论是:pH等于10时,________。
[思考与交流]
(5)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来。根据上图中的信息,给出一种迅速停止反应的方法:________。
参考答案:(1)
实验编号
实验目的
T/K
pH
c/10-3 mol·L-1
H2O2
Fe2+
①
探究温度对降解反应速率的影响
313
3
6.0
0.30
③
探究溶液的pH对降解反应速率的影响
?
?
?
?
?
(2)8.0×10-6
(3)H2O2在温度过高时迅速分解
(4)反应不能进行
(5)在溶液中加入碱溶液,使溶液的pH大于或等于10(其他合理答案均可)
本题解析:(1)依题意可知②的实验温度为313 K,实验对比是建立在其它条件相同前提下,故pH应与①的相同。若改变pH,其它条件不变可探究溶液pH对反应速率的影响。
(2)实验①曲线中,50~150 s时。
Δc(p-CP)=1.2×10-3 mol·L-1-0.4×10-3 mol·L-1=0.8×10-3 mol·L-1,所以v(p-CP)==8.0×10-6 mol·L-1·s-1。
(3)在降解反应中,H2O2新产生的自由基起氧化作用,温度过高,H2O2因热稳定性差而分解,导致降解反应速率下降。
(4)由双曲线③可知,pH=10时,c(p-CP)基本不变,反应趋于停止。
(5)由(4)得到启示:在pH=10溶液中,反应速率趋于零,可将所取样加入NaOH溶液中(使pH=10);化学反应速率随温度降低而降低,故亦可用迅速大幅降温法。
本题难度:一般
5、选择题 已知?4NH3(气)+5O2(气)=4NO(气)+6H2O(气),若反应速率分别是V(NH3)、V(O2)、V(NO)、V(H2O)[mol/L?min]表示,则正确的关系是( )
A.
V(NH3)=V(O2)
B.V(O2)=V(H2O)
C.V(NH3)=V(H2O)
D.V(O2)=V(NO)
参考答案:同一化学反应、同一时间段内,各物质的反应速率之比等于计量数之比.
A、V(NH3):V(O2)=4:5,54V(NH3)=V(O2),故A错误.
B、V(O2):V(H2O)=5:6,65V(O2)=V(H2O),故B错误.
C、V(NH3):V(H2O)=4:6=2:3,32V(NH3)=V(H2O),故C正确.
D、V(O2):V(NO)=5:4,45V(O2)=V(NO),故D错误.
故选C.
本题解析:
本题难度:一般