1、选择题 保持相同的温度,可逆反应2A(g(+B(g) 2C(g)在1×105Pa和1×106Pa条件下分别达到平衡时的逆反应速率,后者与前者相比较?(?)
2C(g)在1×105Pa和1×106Pa条件下分别达到平衡时的逆反应速率,后者与前者相比较?(?)
A.大于
B.小于
C.等于
D.无法确定
参考答案:A
本题解析:略
本题难度:简单
2、选择题 把0.6 mol 气体X 和0.4 mol 气体Y混合于2.0L的密闭容器中,发生如下反应3X(g)+ Y(g)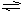 nZ(g)+2W(g),测得5min末已生成0.2 mol W,又知以Z表示的反应速率为0.01 mol·L-1·min-1,则n值是
nZ(g)+2W(g),测得5min末已生成0.2 mol W,又知以Z表示的反应速率为0.01 mol·L-1·min-1,则n值是
A.1
B.2
C.3
D.4
参考答案:A
本题解析:
分析:根据v=  =
= 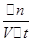 计算A的平均化学反应速率,再根据同一化学反应同一时间段内,各物质的反应速率之比等于计量数之比判断n值.
计算A的平均化学反应速率,再根据同一化学反应同一时间段内,各物质的反应速率之比等于计量数之比判断n值.
解:5min内W的平均化学反应速率= =
= 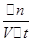 =
=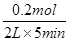 =0.02mol/(L.min),同一化学反应同一时间段内,各物质的反应速率之比等于计量数之比,Z浓度变化表示的平均反应速率为0.01mol/L?min,v(z):v(w)=0.01mol/(L?min):0.02mol/(L.min=n:2),所以n=1,故选A
=0.02mol/(L.min),同一化学反应同一时间段内,各物质的反应速率之比等于计量数之比,Z浓度变化表示的平均反应速率为0.01mol/L?min,v(z):v(w)=0.01mol/(L?min):0.02mol/(L.min=n:2),所以n=1,故选A
本题难度:一般
3、选择题 下列关于实验现象的描述不正确的是( )
A.用锌片做阳极,铁片做阴极,电解氯化锌溶液,铁片表面出现一层锌
B.把铜片和铁片紧靠在一起浸入稀硫酸中,铁片表面出现气泡,铜片表面无气泡
C.把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快
D.把铜片插入三氯化铁溶液中,在铜片表面出现一层铁
参考答案:A.该装置构成电镀池,锌片作镀层,铁片作镀件,电解氯化锌溶液时,在铁片表面镀上一层锌,故A正确;
B.铜、铁和稀硫酸构成原电池,铁作负极,铜作正极,铜电极上氢离子得电子生成氢气,故B错误;
C.锌置换出铜,铜、锌和稀盐酸构成原电池,原电池加快反应速率,故C正确;
D.铜和氯化铁溶液反应生成氯化亚铁、氯化铜,所以不能在铜片表面析出一层铁,故D错误;
故选BD.
本题解析:
本题难度:一般
4、填空题 (12分)有一化学反应2A B+D ,B、D起始浓度为0,在四种不同条件下进行。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表,根据下述数据,完成填空:
B+D ,B、D起始浓度为0,在四种不同条件下进行。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表,根据下述数据,完成填空:
实验
序号
| 浓度(mol/L)
| 时间(min)
|
0
| 10
| 20
| 30
| 40
| 50
| 60
|
1
| 温度
| 800 ℃
| 1.0
| 0.80
| 0.67
| 0.57
| 0.50
| 0.50
| 0.50
|
2
| 800 ℃
| C2
| 0.60
| 0.50
| 0.50
| 0.50
| 0.50
| 0.50
|
3
| 800 ℃
| C3
| 0.92
| 0.75
| 0.63
| 0.60
| 0.60
| 0.60
|
(1)在实验1,反应在0至40分钟时间内A的平均速率为 mol/(L·min)。
(2)在实验2,A的初始浓度C2= mol/L,可推测实验2中隐含的条件是
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则达到平衡时v3 v1(填>、=、<=,)800℃时,反应平衡常数= ,且C3= mol/L,可推测实验3中隐含的条件是 。
(4)800℃时,反应B+D  2A当其他条件不变, B、D的起始浓度为0.50 mol/L , A的起始浓度为0,达到平衡时A的浓度为 mol/L, B的转化率= 。
2A当其他条件不变, B、D的起始浓度为0.50 mol/L , A的起始浓度为0,达到平衡时A的浓度为 mol/L, B的转化率= 。
参考答案:(1)0.0125mol·L-1·min-1;(2)C2="1.0" mol/L,催化剂;
(3)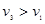 ,反应平衡常数=0.25,且C3=1.2mol/L,增大A的浓度。
,反应平衡常数=0.25,且C3=1.2mol/L,增大A的浓度。
(4)0.5 mol/L,B的转化率=50%。
本题解析:(1)v= =
=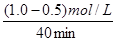 =0.0125mol/(L·min);
=0.0125mol/(L·min);
(2)根据实验1、2数据分析,温度相同,达平衡后A的物质的量浓度相同,且B、D起始浓度为0,所以两组实验中A的起始浓度相同为1.0mol/L ;温度相同,达平衡后A的物质的量浓度相同,但达平衡时2组的时间较短,所以只能是加入催化剂;
(3)实验1、3比较,温度相同,10min-20min时,实验3的浓度减少量都大于实验1的,所以实验3的反应速率大于实验1的,即v3>v1;根据相同条件下,浓度对化学反应速率的影响判断,实验3的起始浓度大于实验1的,即c3>1.0mol/L,800℃时,
2A ? B + D
起始量(mol/L)1.0 0 0
变化量(mol/L)0.5 0.25 0.25
平衡量(mol/L)0.5 0.25 0.25
平衡浓度K=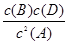 =
= =0.25
=0.25
实验3的温度与实验1的温度相同,温度不变,平衡常数不变;
2A ? B + D
起始量(mol/L) C3 0 0
反应量(mol/L) 0.6 0.30 0.30
平衡量(mol/L) c3-0.60 0.30 0.30
该温度下平衡常数K=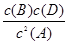 =
=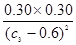 =0.25;
=0.25;
解得:c3=1.2
温度相同,达平衡后A的物质的量浓度增加,但达平衡时3组的时间与1组相同,所以只能是增大A的浓度;
(4)800℃时,2A?B+D K=0.25,则 B+D?2A反应的平衡常数=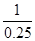 =4,设B消耗物质的量浓度为x;
=4,设B消耗物质的量浓度为x;
反应 B + D ? 2A
起始量(mol/L) 0.5 0.5 0
变化量(mol/L) x x 2x
平衡量(mol/L)0.5-x 0.5-x 2x
平衡常数K= =
=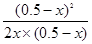 =4
=4
计算得到x=0.25mol/L
达到平衡A的浓度=2×0.25mol/L=0.5mol/L
B的转化率=0.25mol/L0.5mol/L×100%=50%;
考点:考查化学平衡的计算。
本题难度:一般
5、选择题 对于反应M+N P,如果温度每升高10℃,反应速度增加为原来的3倍,在10℃时完成反应的10%需要54min,将温度提高到40℃,完成反应的10%需要的时间为(? )
P,如果温度每升高10℃,反应速度增加为原来的3倍,在10℃时完成反应的10%需要54min,将温度提高到40℃,完成反应的10%需要的时间为(? )
A.2 min
B.3 min
C.6 min
D.9 min
参考答案:A
本题解析:反应由10℃升至40℃,反应速率增加到原来的 =33倍,完成反应10%所需要的时间为
=33倍,完成反应10%所需要的时间为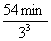 ="2" min。
="2" min。
本题难度:简单