1、计算题 将4.66g卤素互化物BrClx溶于水后,通入足量SO2气体与其反应生成氢溴酸、盐酸和硫酸,再用碱将溶液调至中性后,加入过量Ba(NO3)2溶液,充分反应后滤去沉淀物,再向滤液中加入过量AgNO3溶液,最后得卤化银沉淀15.46g。试计算:
(1)参加反应的AgNO3的物质的量。
(2)BrClx中的x值。
参考答案:0.1 mol; =3
=3
本题解析:质量增加的是Ag的质量
所以n(AgNO3)=  ="0.1" (mol)
="0.1" (mol)
设4.66g卤素互化物BrClx为a mol
BrClx → AgBr? +? xAgCl?质量增加
1mol? 108(1+ )
)
a mol? 15.46g-4.66g
则: ? a=
? a=
所以: =
= ?
? =3
=3
本题难度:简单
2、计算题 用消石灰与Cl2反应制漂白粉,假定消石灰100%转化为漂白粉。某游泳池消毒一次需要4.26 kg Cl2,现改用上述漂白粉,假定起消毒作用的是HClO,要达到与Cl2相当的消毒效果,需向游泳池中投放这种漂白粉多少千克?
参考答案:7.26 kg
本题解析:n(Cl2)= 4.26×103g/71g·mol-1=60mol
Cl2+H2O=HCl+HClO
1? 1
60mol? 60mol
Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
1? 2
30mol?60mol
2Ca(OH)2+2Cl2= Ca(ClO)2+ CaCl2+2H2O
30mol? 30mol
漂白粉质量为30mol×143 g·mol-1+30mol×111 g·mol-1=7620g,即7.26kg
本题难度:简单
3、填空题 氯气是一种有毒气体,但它是一种重要的化工原料,与我们的生活联系也比较密切.
(1)据新闻报道,前不久某地装运液氯的槽罐车发生交通事故,造成大量氯气泄漏,公路附近的村民被紧急疏散.请问:村民应该如何应变______(填编号).
A.应躲到低洼的地方去?B.可用烧碱溶液浸湿软布蒙面
C.可用肥皂水或尿液浸湿软布蒙面?D.应多饮水
E.应到较高的地方去
(2)实验室制取氯气的方法有很多种,其中之一是:KClO3+6HCl=KCl+3Cl2↑+3H2O.该反应中氧化剂是______,还原剂是______,当反应生成标准状况下6.72LCl2时,转移电子的物质的量为______.
(3)日常生活环境可用稀的漂白液等进行消毒,请写出制漂白液的离子方程式______.
参考答案:(1)A.氯气的密度比空气的大,地势较低的地方氯气含量大,中毒的可能性大,躲到低洼的地方去不合理,故A错误;
B.用烧碱溶液浸湿软布蒙面,则会受到浓氢氧化钠的腐蚀,做法不合理,故B错误;
C.肥皂水或尿液呈碱性,氯气能溶于碱性物质的溶液,故C正确;
D.常温下氯气能溶于水,但氯气在水中的溶解度不大,多饮水不能消除氯气的危害,且氯气主要危害呼吸道,故D错误;
E.氯气的密度比空气的大,较高的地方氯气含量较少,故E正确.
故答案为:CE;
(2)KClO3+6HCl=KCl+3Cl2↑+3H2O反应中,Cl元素化合价降低,则KClO3被还原,为氧化剂,HCl为还原产物,
标准状况下6.72LCl2的物质的量为6.72L22.4L/mol=0.3mol,转移的电子数为0.1mol×5=0.5mol,
故答案为:KClO3;HCl;0.5mol;
(3)漂白液由氯气和NaOH溶液反应生成,主要成分是NaCl和NaClO,反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O.
本题解析:
本题难度:一般
4、选择题 将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示。
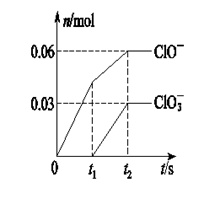
下列说法正确的是( )
A.苛性钾溶液中KOH的质量是4.94 g
B.反应中转移电子的物质的量是0.09 mol
C.氧化性ClO-<ClO
D.ClO的生成是由于温度升高引起的
参考答案:D
本题解析:Cl2通入一定浓度的苛性钾溶液中生成了ClO-和ClO两种离子,CL元素的化合价升高,即还要生成CL—,根据氧化还原反应过程中得失电子数相等可得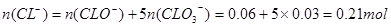 ,根据电荷守恒,得
,根据电荷守恒,得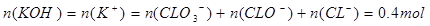 ,A错,
,A错,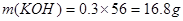 ;B错,反应中转移电子的物质的量是0.21mol;C错,氧化性ClO-<ClO;D正确;
;B错,反应中转移电子的物质的量是0.21mol;C错,氧化性ClO-<ClO;D正确;
本题难度:困难
5、选择题 已知HIO既能与酸反应又能和碱发生中和反应,则它与盐酸反应的产物有( )
A.IO-
B.I2O
C.ICl
D.I-
参考答案:
C
本题解析:
根据题目信息知HIO与盐酸反应时表现出碱的性质,所以此时的产物为ICl和H2O。
本题难度:一般