1、选择题 下列说法中不正确的是
[? ]
A.任何化学反应都伴随着热量的变化
B.化学反应的特征是有新物质生成
C.经过加热而发生的化学反应不一定都是吸热反应
D.只要有化学键的断裂,一定发生化学反应
参考答案:D
本题解析:
本题难度:简单
2、实验题 (12分)如图是某同学设计的放热反应的观察装置。
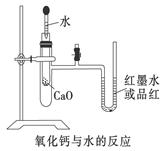
其实验顺序是:①按图所示将实验装置连接好。
②在U形管内加入少量红墨水(或品红)溶液。打开T型管螺旋夹,使U形管内两边的液面处于同一水平面,再夹紧螺旋夹。
③在中间的试管里盛1 g氧化钙,当滴入2 mL左右的蒸馏水后,同时打开螺旋夹即可观察。
试回答:(1)实验中观察到的现象是
________________________________________________________________________
________________________________________________________________________。
(2)该实验中必须进行的一步实验操作是
________________________________________________________________________。
(3)该实验的原理是
________________________________________________________________________
________________________________________________________________________。
(4)实验中反应的化学反应方程式是
________________________________________________________________________。
(5)说明CaO、H2O的能量与Ca(OH)2的能量之间的关系
____________________________________________。
(6)若该实验中CaO换成NaCl,实验还能否观察到相同现象?______。
参考答案:(1)U形玻璃管里的红墨水(或品红)会沿开口端上升
(2)检查装置气密性
(3)CaO和水反应放出热量使大试管中空气膨胀,引起红墨水(或品红)在U形管中的液面不再相平
(4)CaO+H2O===Ca(OH)2
(5)CaO和H2O的能量和大于Ca(OH)2的能量
(6)否
本题解析:该题是一道以能量变化、反应热为背景的实验探讨题,解题时要明确设计者的意图。从提供的仪器和目的来看,意在通过观察U形管里液面变化指示左边装置中发生的反应的热量变化。可自然想到热胀冷缩现象,而在实验中利用大试管里的空气膨胀,故此实验装置必须气密性良好,否则无法观察到现象,弄清楚了这些,问题自然不难解决。
本题难度:一般
3、填空题 如图所示,把试管放入盛有25 ℃饱和石灰水的烧杯中,试管中开始放入几小块镁片,再滴入5 mL稀盐酸,试完成下列问题。
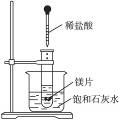
(1)实验中观察到的现象是__________________。
(2)产生上述现象的原因是__________________。
(3)写出有关反应的离子方程式__________________。
(4)由实验推知,MgCl2溶液和H2的总能量__________________(填“大于”“小于”或“等于”)镁片和盐酸的总能量。
参考答案:(1)镁片上有大量气泡产生,镁片逐渐溶解;烧杯中有晶体析出?(2)镁与盐酸反应放出H2,是放热反应,Ca(OH)2在水中的溶解度随温度升高而减小,故析出Ca(OH)2晶体?(3)Mg+2H+====Mg2++H2↑? Ca2++2OH-====Ca(OH)2↓? (4)小于
本题解析:(1)镁与盐酸反应产生氢气,此反应为放热反应,使烧杯内温度升高,Ca(OH)2的溶解度随温度升高而减小,故有晶体Ca(OH)2析出。(4)由镁和盐酸反应生成MgCl2和H2,是放热反应,根据能量变化规律知MgCl2和H2的总能量加上放出的能量应等于Mg和盐酸的总能量,故MgCl2和H2总能量小于Mg和盐酸的总能量。
本题难度:简单
4、选择题 下列有关化学能与热能的说法正确的是?
A.铝热反应属于吸热反应
B.H2→H+H的变化需要吸收能量
C.凡经加热而发生的化学反应都是吸热反应
D.若某反应生成物的总能量大于反应物的总能量,则该反应为放热反应
参考答案:B
本题解析:铝热反应发生时需加热到一定温度,但它过程中释放大量热量,属于放热反应,A、C错;破坏化学键,需要吸收能量,B正确;若某反应生成物的总能量大于反应物的总能量,则该反应为吸热反应,D错。
点评:判断一个反应为吸热反应或放热反应,是历年高考的常考题型,考生可根据反应基本类型进行判断,并注意积累特殊的化学反应的反应热。
本题难度:一般
5、选择题 下列实验事实所引出的相应结论正确的是
选项
| 实验事实
| 结论
|
A
| Na2S2O3溶液与稀H2SO4溶液混合时,其他条件相同,Na2S2O3溶液浓度越大,析出硫沉淀所需时间越短
| 当其他条件不变时,增大反应物浓度化学反应速率加快
|
B
| 在化学反应前后,催化剂的质量和化学性质都没有发生改变
| 催化剂一定不参加化学反应
|
C
| 将NH4Cl晶体与Ba(OH)2.8H2O晶体混合后研磨,烧杯壁温度降低
| 该反应为吸热反应
|
D
| 在容积可变的密闭容器中发生反应
H2(g)+ I2(g)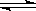 2HI(g), 2HI(g),
把容积缩小一倍
| 正反应速率加快,逆反应速率不变
参考答案:AC
本题解析:
正确答案AC
A、当其他条件不变时,增大反应物浓度化学反应速率加快。
B、在化学反应前后,催化剂的质量和化学性质都没有发生改变,但物理性质改变,催化剂可能参加反应。
C、NH4Cl晶体与Ba(OH)2.8H2O晶体为吸热反应。
D、H2(g)+ I2(g)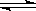 2HI(g),把容积缩小一倍,浓度均增大,正逆反应速率均加快,只是变化的幅度相同,所以平衡不移动。 2HI(g),把容积缩小一倍,浓度均增大,正逆反应速率均加快,只是变化的幅度相同,所以平衡不移动。
本题难度:一般
|