|
高考化学试题《能量的相互转化》高频考点巩固(2019年模拟版)(四)
2019-06-25 23:02:02
【 大 中 小】
|
1、填空题 科学家一直致力于“人工固氮”的方法研究。
(1)合成氨的原理为:N2(g)+3H2(g) 2NH3(g)ΔH="-92.4" kJ/mol,该反应的能量变化如图所示。 2NH3(g)ΔH="-92.4" kJ/mol,该反应的能量变化如图所示。
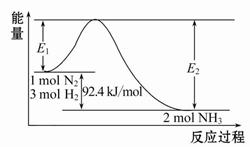
①在反应体系中加入催化剂,反应速率增大,E2的变化是?(填“增大”、“减小”或“不变”)。
②将0.3 mol N2和0.5 mol H2充入体积不变的密闭容器中,在一定条件下达到平衡,测得容器内气体压强变为原来的 ,此时H2的转化率为?;欲提高该容器中H2的转化率,下列措施可行的是?(填选项字母)。 ,此时H2的转化率为?;欲提高该容器中H2的转化率,下列措施可行的是?(填选项字母)。
A.向容器中按原比例再充入原料气
B.向容器中再充入一定量H2
C.改变反应的催化剂
D.液化生成物分离出氨
| (2)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3和TiO2)表面与水发生反应:
2N2(g)+6H2O(l) 4NH3(g)+3O2(g) 4NH3(g)+3O2(g)
ΔH="+1" 530 kJ/mol
又知:H2O(l) H2O(g)? ΔH="+44.0" kJ/mol H2O(g)? ΔH="+44.0" kJ/mol
则2N2(g)+6H2O(g) 4NH3(g)+3O2(g) ΔH=?kJ/mol,该反应的化学平衡常数表达式为K?,控制其他条件不变,增大压强,K值?(填“增大”、“减小”或“不变”)。 4NH3(g)+3O2(g) ΔH=?kJ/mol,该反应的化学平衡常数表达式为K?,控制其他条件不变,增大压强,K值?(填“增大”、“减小”或“不变”)。
参考答案:(1)①减小?②30%? A、D
(2)+1 266?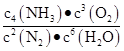 ?不变 ?不变
本题解析:(1)①在反应体系中加入催化剂,活化能降低,E2也减小,反应速率增大。
②? N2?+? 3H2? ?2NH3 ?2NH3
起始 0.3 mol? 0.5 mol? 0
转化? x mol? 3x mol? 2x mol
平衡 (0.3-x)mol (0.5-3x)mol? 2x mol
根据题意有(0.3-x)mol +(0.5-3x)mol+ 2x mol=0.7,解得x=0.05,H2转化
0.15 mol,转化率为30%。
欲提高转化率可以按原比例向容器中再充入原料气(相当于加压),液化生成物分离出氨,也可以降温。
(2)由盖斯定律消去H2O(l)可得,2N2(g) + 6H2O(g) 4NH3(g)+3O2 (g) 4NH3(g)+3O2 (g)
ΔH ="+1" 266 kJ·mol-1。
该反应的平衡常数表达式可以表示为K=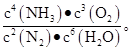 ?K只受温度的影响,控制其他条件不变,增大压强,K值不变 ?K只受温度的影响,控制其他条件不变,增大压强,K值不变
本题难度:一般
2、选择题 已知298K时,2SO2(g)+O2(g) 2SO3(g);△H=-197kJ·mol-1。现有同一温度下的三个体积相同的密闭容器,在第一个容器中通入2molSO2和1molO2,达到平衡时,反应放出的热量为Q1;向第二个密闭容器中通入1molSO2和0.5molO2,达到平衡时放出的热量为Q2;在第三个密闭容器中通入1molSO2、0.5molO2和1molSO3达到平衡时放出的热量为Q3。下列关系正确的是 2SO3(g);△H=-197kJ·mol-1。现有同一温度下的三个体积相同的密闭容器,在第一个容器中通入2molSO2和1molO2,达到平衡时,反应放出的热量为Q1;向第二个密闭容器中通入1molSO2和0.5molO2,达到平衡时放出的热量为Q2;在第三个密闭容器中通入1molSO2、0.5molO2和1molSO3达到平衡时放出的热量为Q3。下列关系正确的是
A.Q1=Q3=197kJ
B.Q1=Q3<197kJ
C.Q1=2Q2 <197kJ
D.Q2<Q1<197kJ
参考答案:D
本题解析:因为是可逆反应,所以反应物的转化率不能为100%,第一个容器相当于是在第二容器的基础上缩小容器体积,所以有利于提高SO2的转化率,则则2Q2<Q1<197kJ。第三容器和第一个容器的平衡状态是等效的,但放出的热量一定是小于Q1,答案选D。
本题难度:一般
3、填空题 CO、NO、NO2、SO2等都是污染大气的有害 气体,对其进行回收利用是节能减排的重要课题。
(1)上述四种气体直接排入空气中会引起酸雨的有?。
(2)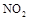 可用尿素 可用尿素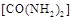 还原(尿素中C元素的化合价为+4价),反应的方程式为: 还原(尿素中C元素的化合价为+4价),反应的方程式为: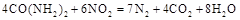 。当消耗掉12g尿素时,转移电子的物质的量是?。 。当消耗掉12g尿素时,转移电子的物质的量是?。
(3)SNCR-SCR是一种新型的烟气脱硝技术(除去烟气中的 ),改流程中发生的主要反应有: ),改流程中发生的主要反应有:
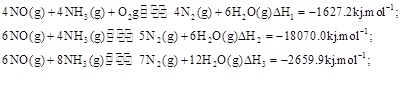
则反应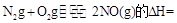 ?KJ/mol ?KJ/mol
(4)CO可用于合成甲醇,反应方程式为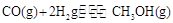 。在一容积可变的密闭容器中充有10mol CO和20molH2,在催化剂作用下发生反应生成甲醇,CO的平衡转化率(a)与温度(T)、压强(P)的关系如图所示。 。在一容积可变的密闭容器中充有10mol CO和20molH2,在催化剂作用下发生反应生成甲醇,CO的平衡转化率(a)与温度(T)、压强(P)的关系如图所示。
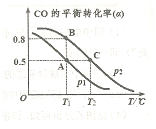
则该反应是 ?0(填“>”或“<”)。若达到平衡状态A时,容器的体积为10L,则在平衡状态B时容器的体积为?L。 ?0(填“>”或“<”)。若达到平衡状态A时,容器的体积为10L,则在平衡状态B时容器的体积为?L。
(5)工业上用氨水将来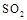 转化成都(NH4)2SO3,再氧化成(NH4)2SO4,(NH4)2SO4溶液中离子浓度大小顺序为?;已知25℃时,0.05mol/L(NH4)2SO4溶液的 转化成都(NH4)2SO3,再氧化成(NH4)2SO4,(NH4)2SO4溶液中离子浓度大小顺序为?;已知25℃时,0.05mol/L(NH4)2SO4溶液的 ,则 ,则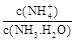 =?(用含a的代数式表示,已知 =?(用含a的代数式表示,已知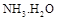 的电离常数 的电离常数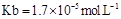 )。 )。
参考答案:
(1)NO、NO2、SO2(2分)?
(2)1.2 mol(2分)
(3)179.8(2分)
(4)<(2分) 2(2分)
(5)c(NH4+)>c(SO42-)>c(H+)>c(OH-)(2分)? 1.7×109-a?(2分)
本题解析:(1)酸雨分为硝酸型酸雨和硫酸型酸雨,所以NO、NO2、SO2都会引起酸雨。(2)尿素中C元素的化合价为+4价,反应中只有N元素变价,4molCO(NH2)2中-3价的N失去24mol电子,6molNO2中+4价的N得到24mol电子,生成7mol N2共转移24mol电子,则12g(0.2mol)尿素时消耗时,共转移1.2 mol电子。(3)求算反应N2(g)+O2(g)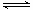 2NO(g)的ΔH,只用到前两个反应,ΔH1-ΔH2即可得到。(4)据图像可知,温度升高平衡逆向移动,所以ΔH<0。T1时,A点对应的α=0.5,据平衡常数表达式可得K=1。因B点与A点温度相同,K不变,可计算出体积为2L。(5)(NH4)2SO4溶液中NH4+水解显酸性,则离子浓度大小顺序为c(NH4+)>c(SO42-)>c(H+)>c(OH-);0.05mol·L-1(NH4)2SO4溶液的pH=a,则c(OH-)=10a-14,依据Kb的表达式和已知数据,可计算出结果为1.7×109-a。 2NO(g)的ΔH,只用到前两个反应,ΔH1-ΔH2即可得到。(4)据图像可知,温度升高平衡逆向移动,所以ΔH<0。T1时,A点对应的α=0.5,据平衡常数表达式可得K=1。因B点与A点温度相同,K不变,可计算出体积为2L。(5)(NH4)2SO4溶液中NH4+水解显酸性,则离子浓度大小顺序为c(NH4+)>c(SO42-)>c(H+)>c(OH-);0.05mol·L-1(NH4)2SO4溶液的pH=a,则c(OH-)=10a-14,依据Kb的表达式和已知数据,可计算出结果为1.7×109-a。
本题难度:一般
4、选择题 在一定条件下,A和B反应可生成C和D,其能量变化如下:

下列有关反应A+B=C+D的说法正确的是(?)
A.反应前后原子的种类和数目可能改变
B.该反应若有热量变化,则一定是氧化还原反应
C.若该反应为放热反应,则不需加热反应就一定能进行
D.该反应遵循能量守恒,所以一定有能量变化
参考答案:D
本题解析:A选项,错误,在化学反应中原子的种类和数目一定不发生改变。B选项,错误。凡是化学反应,都将伴随着能量的变化。故不一定为氧化还原反应。C选项错误。有很多放热反应在反应前需加热达到反应温度才能进行反应,如铝热反应 ,有机物燃烧等。D选项正确。
本题难度:一般
5、选择题 下列叙述正确的是
A.化学反应除了生成新的物质外,还伴随着能量的变化
B.物质燃烧一定是放热反应
C.放热的化学反应不需要加热就能发生
D.吸热反应不加热就不会发生
参考答案:AB
本题解析:A是化学变化的两个基本特征,正确。燃烧一定是放热的,B正确。反应是放热反应,还是吸热反应和反应条件无关,只与反应物和生成物的能量的相对大小有关系,所以答案选AB。
本题难度:简单
|  4NH3(g)+3O2(g)
4NH3(g)+3O2(g) H2O(g)? ΔH="+44.0" kJ/mol
H2O(g)? ΔH="+44.0" kJ/mol 4NH3(g)+3O2(g) ΔH=?kJ/mol,该反应的化学平衡常数表达式为K?,控制其他条件不变,增大压强,K值?(填“增大”、“减小”或“不变”)。
4NH3(g)+3O2(g) ΔH=?kJ/mol,该反应的化学平衡常数表达式为K?,控制其他条件不变,增大压强,K值?(填“增大”、“减小”或“不变”)。