1、选择题 在NO2与H2O的反应中,发生还原反应和发生氧化反应的物质的质量比为(?)。
A.3:1
B.1:3
C.1:2
D.2:1
参考答案:C
本题解析:3 NO2 +H2O=2HNO3 +NO,NO2与水发生岐化反应,3个N原子中有两个N自+4价升高至+5价,另一下降低至+2价,故答案为C
本题难度:一般
2、选择题 下列反应的化学方程式书写正确的是
[? ]
A.Na在空气中燃烧:4Na+O2 2Na2O
2Na2O
B.Fe粉与水蒸气反应:2Fe+6H2O(g) 2Fe(OH)3 +3H2
2Fe(OH)3 +3H2
C.常温下N2与O2混合:N2+O2 =2NO
D.SO3与NaOH溶液反应:SO3+2NaOH= Na2SO4+ H2O
参考答案:D
本题解析:
本题难度:简单
3、选择题 下列化学用语正确的是(? )

A.次氯酸的电子式:
B.CH4Si的结构式: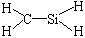
C.HCN分子的结构式:H-C≡N
D.丙烷分子的比例模型: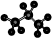
参考答案:C
本题解析:A 错误,氧原子和氯原子颠倒一下
B 错误,碳原子和硅原子应该以双键相连
C 正确
D 错误,这是球棍模型,不是比例模型
本题难度:简单
4、填空题 已知33As、35Br位于同一周期。某反应中反应物与生成物有以下几种:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和未知物质X。
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是 。
(2)已知0.2 mol KBrO3在反应中得到1 mol电子生成X,则X的化学式是 。
(3)在该反应条件下可推知 (填序号)。
a.氧化性:KBrO3>H3AsO4
b.氧化性:H3AsO4>KBrO3
c.还原性:AsH3>X
d.还原性:X>AsH3
(4)将该反应方程式配平后,氧化剂和还原剂的物质的量之比为 ,其中1 mol KBrO3得到电子的物质的量为 mol。
参考答案:(1)AsH3 (2)Br2 (3)ac (4)8∶5 5
本题解析:(1)KBrO3在反应中得到电子,化合价降低,KBrO3为氧化剂,则X为对应的还原产物。比较余下物质中各元素化合价的变化,可知AsH3在反应中失去电子,为还原剂,被氧化生成H3AsO4。(2)设X中Br元素的化合价为x,则有:0.2 mol×(5-x)=1 mol,解得x=0,故X为Br2。(3)写出化学反应方程式:AsH3+KBrO3+H2SO4
本题难度:一般
5、选择题 有一钠块放置于潮湿空气中,表面氧化变质,且仍为白色块状固体,称其质量为25g,将其全部投入足量水中反应,得到溶液1000mL,并收集到气体2.24L(标准状况下的纯净物),再取此溶液100mL,用1mol/L的盐酸滴定至中性,用去70mL,并将滴定过程中产生的气体通入到足量的澄清石灰水中,得到干燥的沉淀1g,则金属钠的氧化率为( )
A.18.4%
B.71.4%
C.81.6%
D.28.6%
参考答案:金属钠和水反应生成氢氧化钠和氢气,氧化钠能和水反应生成氢氧化钠,所以收集到气体2.24L全部为氢气,氢气的物质的量n=2.24L22.4L/mol=0.1mol,质量为:0.1mol×2g/mol=0.2g,
设收集到气体2.24L氢气时,消耗金属钠的质量为m,生成氢氧化钠的质量为x,
则? 2Na+2H2O=2NaOH+H2↑?
?46?80? 2
?m?x?0.2g
所以?80x=20.2g? ?46m=20.2g,解得x=8g,m=4.6g,即金属钠的质量是4.6g,即出未被氧化的钠的物质的量为0.2mol,生成氢氧化钠8g,即0.2mol,根据HCl+NaOH=NaCl+H2O,所以得到溶液1000mL中共含有氢氧化钠的物质的量是1mol/L×0.07L×10=0.7mol,或者根据电中性原则,求出取出的100mL溶液中n(Na+)=n(Cl-)=1mol/L×0.07L=0.07mol,则1000mL溶液中n(Na+)=0.7mol,这就是整个钠块中钠的物质的量,故金属钠的氧化率为0.7mol-0.2mol0.7mol×100%=71.4%.
故选B.
本题解析:
本题难度:简单