1、推断题 下图是六种物质的相互转化关系.已知E是 固态 单质,六种物质中均含有构成E的元素。
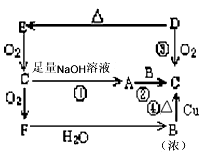
(1)写出各物质的化学式
A________B________C________D________E________F________
(2)写出①④的化学方程式
①________________________④_________________________
参考答案:(1)A:Na2SO3;B:H2SO4;C:SO2;D:H2S;E:S;F:SO3
(2)①SO2+2NaOH==Na2SO3+H2O;④Cu+2H2SO4(浓) CuSO4+SO2↑+H2O
CuSO4+SO2↑+H2O
本题解析:
本题难度:一般
2、简答题 X、Y、Z、L、M五种元素的原子序数依次增大.X、Y、Z、L是组成蛋白质的基础元素,M是生活中最常用的金属,它与L可以形成三种化合物.
请回答下列问题:
(1)Y在元素周期表中的位置为______.
(2)硒(se)是人体必需的微量元素,与L同一主族,该族2~5周期元素单质分别与H2反应生成l?mol气态氢化物的反应热如下,表示生成1mol硒化氢反应热的是______(填字母代号).
a.+99.7mol?L-1?b.+29.7mol?L-1?c.-20.6mol?L-1?d.-241.8kJ?mol-1
(3)已知(YZ)2分子所有的原子都满足8电子,请写出其结构式______;(YZ)2可以与X2化合生成XYZ,其水溶液是一种酸,某浓度该酸的钾盐(KYZ)溶液能使酚酞溶液显红色,请用离子方程式表示原因______.
(4)L、X两元素按原子数目比l:1和1:2形成分子A和B.
①用电子式表示B的形成过程______.
②M在高温下可以与B反应,写出该反应的化学方程式______.
某同学将反应得到的黑色粉末全部溶于足量的硫酸溶液中,发现有少量的气泡产生,溶液呈棕黄色,该同学判断溶液中一定同时存在两种M的金属阳离子.请你选择合适的试剂与合理的步骤证明该同学的推断______.
③若该同学将上述棕黄色溶液1mL加入到2mL?A的浓溶液中,预计会看到的实验现象是______.
参考答案:X、Y、Z、L、M五种元素的原子序数依次增大.X、Y、Z、L是组成蛋白质的基础元素,则X为氢、Y为碳、Z为氮、L为氧;M是生活中最常用的金属,它与L可以形成三种化合物,则铁与氧元素可形成氧化亚铁、氧化铁、四氧化三铁,即M为铁;
(1)Y为碳,其质子数为6,电子排布中共有2个电子层,最外层电子数为4,则在周期表中第二周期,第ⅣA族,故答案为:第二周期,第ⅣA族;
(2)因该族2~5周期元素非金属性O>S>Se>Te,非金属性越强,与氢气化合放出的热量越多,显然生成1mol硒化氢反应热为b,故答案为:b;
(3)因N原子最外层5个电子,C原子最外层4个电子,为满足(CN)2分子所有的原子都满足8电子结构,其结构式为N≡C-C≡N,KCN溶液能使酚酞溶液显红色,是因CN-水解生成氢氧根离子使溶液显碱性,水解离子方程式为CN-+H2O

HCN+OH-,故答案为:N≡C-C≡N;CN-+H2O

HCN+OH-;
(4)①因B为水,氢原子最外层1个电子,氧原子最外层6个电子,则1个氧原子结合2个氢原子,其形成过程为
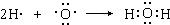
,
故答案为:
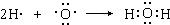
;
②由铁与水蒸气反应生成四氧化三铁和氢气,该反应为3Fe+4H2O?高温?.?Fe3O4+4H2↑,四氧化三铁与硫酸反应后溶液中一定同时存在两种M的金属阳离子为铁离子和亚铁离子,则取溶液少许,滴加KSCN溶液,溶液变红色,证明有Fe3+,另取溶液少许,加入KMnO4酸性溶液,紫色褪去,证明有Fe2+,
故答案为:3Fe+4H2O?高温?.?Fe3O4+4H2↑;取溶液少许,滴加KSCN溶液,溶液变红色,证明有Fe3+,另取溶液少许,加入KMnO4酸性溶液,紫色褪去,证明有Fe2+;
③A为过氧化氢,在铁离子的催化作用下分解生成氧气,则会观察到有大量气泡出现,故答案为:有大量气泡出现.
本题解析:
本题难度:一般
3、推断题 (14分)下图中,B、D、E、F、G是氧化物,F、K是氢化物,C、H是日常生活中最常见的金属单质,J是气态非金属单质。O是白色沉淀且B、H、L、M、N、O中含有同种元素,I是基础化学工业的重要产品
(图中部分反应物和生成物没有列出)。
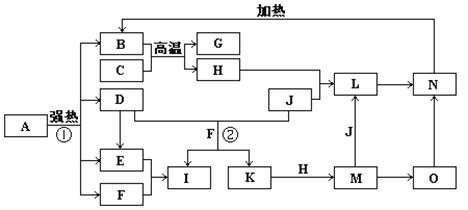
请按要求回答:
⑴写出G、L的化学式G:?,L:?。
⑵反应②的离子方程式 ?。
⑶反应①是分解反应,反应中生成的B、D、E、F的物质的量之比为
1∶1∶1∶14,则该反应的化学方程式为 ?。
⑷将A直接溶于水(未加稀硫酸酸化)得到的溶液,敞口久置,变质过程中涉及的离子方程式为 ?。
参考答案:(1)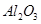 、
、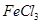
(2)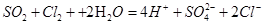
(3)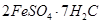

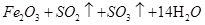
(4)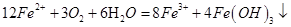
本题解析:抓住B、D、E、F、G是氧化物,F、K是氢化物,C、H是日常生活中最常见的金属单质,B + C→G + H反应条件又是高温,很容易想到是铝热反应,C是铝 G是氧化铝
K + H →M? K是氢化物,? O是白色沉淀且B、H、L、M、N、O中含有同种元素
J+H→L? M+J→L? L→N? M→O? O→N? N→B?根据关系可以断定B、H、L、M、N、O中含有同种元素是Fe?所以 D二氧化硫 E 三氧化硫F 水H 铁I 硫酸J?氯气 K 盐酸L氯化铁 M 氯化亚铁O氢氧化亚铁 N 氢氧化铁? B 氧化铁,综合分析知道A是七水合硫酸亚铁,所以⑴G、L的化学式G: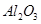 ,L:
,L: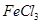
⑵反应②的离子方程式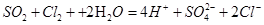
⑶反应①是分解反应,反应中生成的B、D、E、F的物质的量之比为
1∶1∶1∶14,则该反应的化学方程式为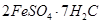

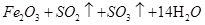
⑷将A直接溶于水(未加稀硫酸酸化)得到的溶液,敞口久置,亚铁会被空气中的氧气氧化成三价铁,变质过程中涉及的离子方程式为 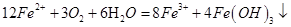
点评:无机化合物之间的转化试题综合考查了学生对无机化合物之间反应的掌握。解答此类题目主要是要主抓突破口,前后联系题中的信息即可解决问题。
本题难度:一般
4、填空题 在一次兴趣小组活动中,一小组利用物质间的互变,设计成一平面“魔方”如图所示。已知:
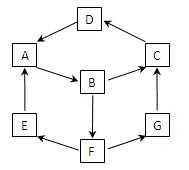
①A、B、C、D、G含有同种元素。
②E是通常情况下密度最小的气体;B与硝酸银溶液反
应生成不溶于稀硝酸的白色沉淀;B也能将一种能形成酸
雨的氧化物氧化为F,F是一种含氧酸,且F的稀溶液
能与A反应生成E和G。
物质
| 纯A(单质)
| B(溶液)
| D(固体)
| G(溶液)
|
颜色
| 银白色
| 黄色
| 红棕色
| 浅绿色
|
③几种物质的部分物理性质:
依据以上信息填空:
(1)G生成C的过程中所出现的现象为?;
(2)写出下列反应的化学方程式:
A→B :?;
(3)写出下列反应的离子方程式:
B→F:?;
酸性条件下,G与次氯酸溶液反应:?;
(4)使一定质量的Zn与100mL18.5 mol·L-1酸F的浓溶液充分反应,Zn完全溶解,同时生成标准状况下的气体A 33.6L。将反应后的溶液稀释至1L,测得溶液中c(H+)=0.1mol·L-1,则气体A的成份及体积比为?。
参考答案:(1)先产生白色沉淀,逐渐变为灰绿色,最后变为红褐色。
(2)
(3)2Fe3++SO2+2H2O = 2Fe2++SO42-+4H+? 2Fe2++HClO + H+ = 2Fe3++Cl-+H2O
(4)V(SO2):V(H2)=" 1:4?"
本题解析:略
本题难度:一般
5、实验题 (12分)用如图所示装置(夹持仪器省略)进行实验,将液体A逐滴加入到固体B中,回答下列问题:
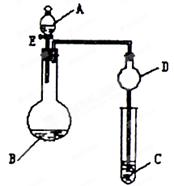
(1)图中D装置在实验中的作用是??。
(2)若 A为30%H2O2溶液,B为MnO2,C盛有氢硫酸( H2S)饱和溶液,旋开E后,C中出现浅黄色浑浊的现象,写出C中发生反应的化学方程式为?
H2S)饱和溶液,旋开E后,C中出现浅黄色浑浊的现象,写出C中发生反应的化学方程式为? ?。
?。
(3)若A为浓盐酸,B为KMnO4,C中盛有KI淀粉溶液,旋开E后,C中的现象是??;继续通气体于C中,足够长的时间后,发现C中溶液的颜色消失,这是因为在溶液中I2能被Cl2氧化为HIO3(碘酸为强酸),写出该反应的离子反应方程式?。
(4)若A为浓氨水,B为生石灰,C中盛有AlCl3溶液,旋开E,足够长的时间后,C中的现象是?,C中发生反应的离子方程式为?。
参考答案:(12分)⑴防倒吸
⑵2H2S + O2 ="=" 2S ↓ + 2 H2O
⑶溶液由无色变成蓝色;6H2O +I2 +5Cl2===2IO3- + 10Cl- +12H+
+12H+
⑷有白色沉淀生成? Al3++3NH3.H2O ="==" Al(OH)3↓+ 3NH4+
本题解析:略
本题难度:一般