1、填空题 已知X、Y、Z为单质,其他为化合物。其中Y为气体,G溶液呈黄色,E是不溶于水的酸性氧化物,能与氢氟酸反应,它们之间存在如下转化关系(部分产物已略去)。请回答下列问题:
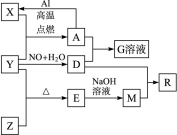
(1)写出物质E的一种用途:__________。
(2)写出A和D的稀溶液反应生成G的离子方程式______________________________。
(3)向含4 mol D的稀溶液中,逐渐加入X粉末至一定量。假设D完全反应且生成的气体只有一种,则反应的X的物质的量范围为___________________ mol。
参考答案:(1)E为SiO2,用途:制光导纤维、玻璃等等。符合题意即可。
(2)3Fe3O4+28H++NO— 3=9Fe3++NO↑+14H2O ?(3) 1~1.5
本题解析:根据题目叙述及格物质之间的关系可知;X:Fe;Y:O2;Z:Si;A:Fe3O4;D:HNO3;E:SiO2; M:Na2SiO3; R:H2SiO3;G:Fe(NO3)3. (1)物质 E为SiO2,用途:制光导纤维、玻璃等等.(2) Fe3O4和HNO3反应的离子方程式是:3Fe3O4+28H++NO— 3=9Fe3++NO↑+14H2O。(3)在含有4mol的硝酸的溶液中,若Fe完全反应转化为Fe(NO3)3。反应为:Fe+4HNO3= Fe(NO3)3+NO↑+2H2O.消耗Fe1mol; 若Fe完全反应转化为Fe(NO3)2。反应为:3Fe+8HNO3= 3Fe(NO3)2+2NO↑+4H2O.消耗Fe1.5mol;若反应产物既有Fe(NO3)3又有Fe(NO3)2,则消耗的Fe的物质的量在1—1. 5mol之间。故反应的X的物质的量范围为1~1.5 mol。
本题难度:一般
2、选择题 下列各组物质中,不是按
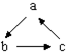
(“→”表示一步完成)关系相互转化的是( )
| 选项 | A | B | C | D
a
Fe
CH2=CH2
Al(OH)3
H2SO4
b
FeCl3
CH3-CH2Br
NaAlO2
SO2
c
FeCl2
CH3CH2OH
Al2O3
SO3
|
A.A
B.B
C.C
D.D
参考答案:C
本题解析:
本题难度:简单
3、填空题 (10分,每空2分)A、B、C、X均为中学化学常见的纯净物,它们之间有如下转化关系(副产物已略去)。
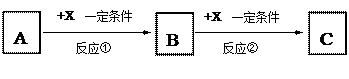
(1)若X是空气中存在的强氧化性无色气体单质,则A可能是___________ (填序号)
(填序号)
a.C? b.Al? c.S? d.Mg?
(2)若X是日常生活中最常用的金 属单质,A是气体单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,X在气体A中燃烧产生棕黄色的烟。
属单质,A是气体单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,X在气体A中燃烧产生棕黄色的烟。
反应②的离子方程式为:?
C溶液中加入NaOH溶液后产生的现象是?
(3)若A在常温下为气态化合物,C是红棕色的气体,C与水反应后所得的浓溶液D与铜反应又生成C气体。则:反应①的化学方程式:??;
D的稀溶液与铜反应的离子方程式为:?
参考答案:

本题解析:略
本题难度:一般
4、简答题 X、Y、Z、L、M五种元素的原子序数依次增大.X、Y、Z、L是组成蛋白质的基础元素,M是生活中最常用的金属,它与L可以形成三种化合物.
请回答下列问题:
(1)Y在元素周期表中的位置为______.
(2)硒(se)是人体必需的微量元素,与L同一主族,该族2~5周期元素单质分别与H2反应生成l?mol气态氢化物的反应热如下,表示生成1mol硒化氢反应热的是______(填字母代号).
a.+99.7mol?L-1?b.+29.7mol?L-1?c.-20.6mol?L-1?d.-241.8kJ?mol-1
(3)已知(YZ)2分子所有的原子都满足8电子,请写出其结构式______;(YZ)2可以与X2化合生成XYZ,其水溶液是一种酸,某浓度该酸的钾盐(KYZ)溶液能使酚酞溶液显红色,请用离子方程式表示原因______.
(4)L、X两元素按原子数目比l:1和1:2形成分子A和B.
①用电子式表示B的形成过程______.
②M在高温下可以与B反应,写出该反应的化学方程式______.
某同学将反应得到的黑色粉末全部溶于足量的硫酸溶液中,发现有少量的气泡产生,溶液呈棕黄色,该同学判断溶液中一定同时存在两种M的金属阳离子.请你选择合适的试剂与合理的步骤证明该同学的推断______.
③若该同学将上述棕黄色溶液1mL加入到2mL?A的浓溶液中,预计会看到的实验现象是______.
参考答案:X、Y、Z、L、M五种元素的原子序数依次增大.X、Y、Z、L是组成蛋白质的基础元素,则X为氢、Y为碳、Z为氮、L为氧;M是生活中最常用的金属,它与L可以形成三种化合物,则铁与氧元素可形成氧化亚铁、氧化铁、四氧化三铁,即M为铁;
(1)Y为碳,其质 子数为6,电子排布中共有2个电子层,最外层电子数为4,则在周期表中第二周期,第ⅣA族,故答案为:第二周期,第ⅣA族;
(2)因该族2~5周期元素非金属性O>S>Se>Te,非金属性越强,与氢气化合放出的热量越多,显然生成1mol硒化氢反应热为b,故答案为:b;
(3)因N原子最外层5个电子,C原子最外层4个电子,为满足(CN)2分子所有的原子都满足8电子结构,其结构式为N≡C-C≡N,KCN溶液能使酚酞溶液显红色,是因CN-水解生成氢氧根离子使溶液显碱性,水解离子方程式为CN-+H2O

HCN+OH-,故答案为:N≡C-C≡N;CN-+H2O

HCN+OH-;
(4)①因B为水,氢原子最外层1个电子,氧原子最外层6个电子,则1个氧原子结合2个氢原子,其形成过程为
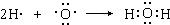
,
故答案为:
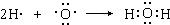
;
②由铁与水蒸气反应生成四氧化三铁和氢气,该反应为3Fe+4H2O?高温?.?Fe3O4+4H2↑,四氧化三铁与硫酸反应后溶液中一定同时存在两种M的金属阳离子为铁离子和亚铁离子,则取溶液少许,滴加KSCN溶液,溶液变红色,证明有Fe3+,另取溶液少许,加入KMnO4酸性溶液,紫色褪去,证明有Fe2+,
故答案为:3Fe+4H2O?高温?.?Fe3O4+4H2↑;取溶液少许,滴加KSCN溶液,溶液变红色,证明有Fe3+,另取溶液少许,加入KMnO4酸性溶液,紫色褪去,证明有Fe2+;
③A为过氧化氢,在铁离子的催化作用下分解生成氧气,则会观察到有大量气泡出现,故答案为:有大量气泡出现.
本题解析:
本题难度:一般
5、判断题 ?
小题1:EDTA是乙二胺四乙酸的英文名称的缩写,市售试剂是其二水合二钠盐。
⑴画出EDTA二钠盐水溶液中浓度最高的阴离子的结构简式。
⑵ Ca(EDTA)2-溶液可用于静脉点滴以排除体内的铅。写出这个排铅反应的化学方程式(用Pb2+ 表示铅)。
⑶能否用EDTA二钠盐溶液代替Ca(EDTA) 2-溶液排铅?为什么?
小题2:氨和三氧化硫反应得到一种晶体,熔点205oC,不含结晶水。晶体中的分子有一个三重旋转轴,有极性。画出这种分子的结构式,标出正负极。
小题3:Na2[Fe(CN)5(NO)]的磁矩为零,给出铁原子的氧化态。Na2[Fe(CN)5(NO)]是鉴定S2-的试剂,二者反应得到紫色溶液,写出鉴定反应的离子方程式。
小题4:CaSO4 ? 2H2O微溶于水,但在HNO3 ( 1 mol L?1)、HClO4 ( 1 mol L-1)中可溶。写出能够解释CaSO4在酸中溶解的反应方程式。
小题5:取质量相等的2份PbSO4 (难溶物)粉末,分别加入HNO3 ( 3 mol L-1) 和HClO4 ( 3 mol L-1),充分混合,PbSO4在HNO3 能全溶,而在HClO4中不能全溶。简要解释PbSO4在HNO3中溶解的原因。
小题6:X和Y在周期表中相邻。CaCO3与X的单质高温反应,生成化合物B和一种气态氧化物;B与Y的单质反应生成化合物C和X的单质;B水解生成D;C水解生成E,E水解生成尿素。确定B、C、D、E、X和Y。?
参考答案:
小题1:⑴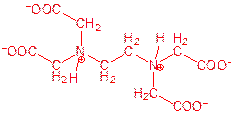
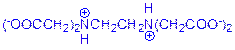 或
或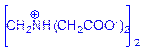 ?,质子必须在氮原子上。
?,质子必须在氮原子上。
⑵? Pb2+ + Ca(EDTA) 2-= Ca 2+ + Pb (EDTA) 2-?
⑶不能。若直接用EDTA二钠盐溶液,EDTA阴离子不仅和Pb2+反应, 也和体内的Ca2+结合造成钙的流失。
小题2: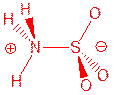
硫氧键画成双键或画成S→O,氮硫键画成N→S,均不影响。其他符合题设条件(有三重轴,有极性)的结构也可。
小题3:Fe(II),或II 或+2
[Fe(CN)5(NO)]2-+S2-= [Fe(CN)5(NOS)]4-
小题4:CaSO4 + H+ = Ca2+ + HSO4-
写成 2CaSO4 + 2HNO3 = Ca(NO3)2 + Ca(HSO4)2也可。高氯酸同。
小题5:Pb2+与NO3-形成络离子(配离子或配合物)。
写方程式也可,如PbSO4 + H+ + NO3- = HSO4- + Pb(NO3)+。若将络离子(配离子或配合物)写成Pb(NO3)2或Pb(NO3)3-也得分,但方程式须配平。
小题6:B: CaC2?C: CaCN2? D: C2H2 或Ca(OH) 2? E: NH2CN? [C(NH)2也可]? X: C? Y: N
本题解析:
小题1:
⑴HY2-中存在碱性基团——氨基和酸性基团——羧基,因此在NaH2Y中,羧基失去质子,氨基中氮原子质子化。
⑵根据题意,Pb2+与EDTA2-形成稳定络合物,排出体外。
⑶若直接用EDTA二钠盐溶液,EDTA阴离子不仅和Pb2+反应, 也和体内的Ca2+结合造成钙的流失。
小题2:SO3是BF3的等电子体,与NH3发生简单加成反应。由于氮原子的电负性大于S原子的电负性,所以N原子带部分单位负电荷,S原子带部分单位正电荷。
小题3:由于μ=0,所以中心原子(Fe)不存在成单电子。由于Fe(Ⅲ)是d5结构,不论是内轨型,还是外轨型,都有成单电子,具有顺磁性,只有内轨型的Fe(Ⅱ)配位化合物没有成单电子,磁矩为零。
小题4:HNO3与HClO4都为强酸,电离出来的H+与SO42-结合生成较弱的电解质HSO4-,从而促使CaSO4(s) Ca2++SO42-向溶解的方向进行,而在水中,由于H+浓度小,酸效应不明显,因此在水中不溶。
Ca2++SO42-向溶解的方向进行,而在水中,由于H+浓度小,酸效应不明显,因此在水中不溶。
小题5:PbSO4能溶于HNO3,但在HClO4不全溶,这说明NO3-与Pb2+能形成更稳定的配离子,使得[Pb2+]减小,从而s促进PbSO4完全溶解。(配位效应)
小题6:CaCO3在高温下与X的单质反应,这是高中典型化学反应,即生成CaC2的化学反应,根据B生成的最终产物分析,Y是N元素。根据原子守恒,C为CaCN2,水解产物为NH2CN,进一步水解生成尿素。
本题难度:一般